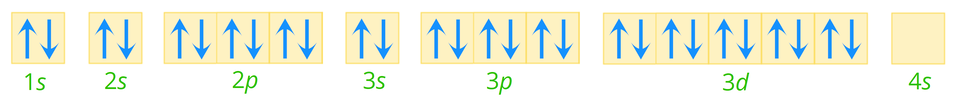
Sprawdź się
Wybierz właściwe słowo.
Od struktury zewnętrznej powłoki elektronowej nie zależą:
Który z poniższych pierwiastków tworzy stabilne związki na stopniu utlenienia?
Oceń, czy podane poniżej informacje są prawdziwe.
Konfiguracja pewnego pierwiastka na stopniu utlenienia wygląda w następujący sposób: . Jaki to pierwiastek? Uzupełnij podpowłokową konfigurację elektronową elektronów walencyjnych tego pierwiastka w stanie podstawowym.
Miedź w przeciwieństwie do innych pierwiastków z okresu bloku układu okresowego tworzy stabilne związki na stopniu utlenienia, takie jak jodek miedzi() czy chlorek miedzi().
Uzupełnij konfigurację pełną podpowłokową miedzi () w stanie podstawowym.
Zapisz pełną konfigurację elektronową kationu miedzi na stopniu utlenienia w formie graficznej (tzw. zapis klatkowy) w stanie podstawowym.
Zapisz pełną konfigurację elektronową kationu miedzi na stopniu utlenienia w stanie podstawowym.
Liczba elektronów walencyjnych i jest zgodna z kolejną numeracją grupy. Pierwiastki np. grupy mają łącznie elektronów walencyjnych i, tracąc kolejno elektrony, mogą osiągnąć najwyższy stopień utlenienia.
Indeks dolny Źródło: Pajdowski L., Chemia ogólna, Warszawa 2002. Indeks dolny koniecŹródło: Pajdowski L., Chemia ogólna, Warszawa 2002.
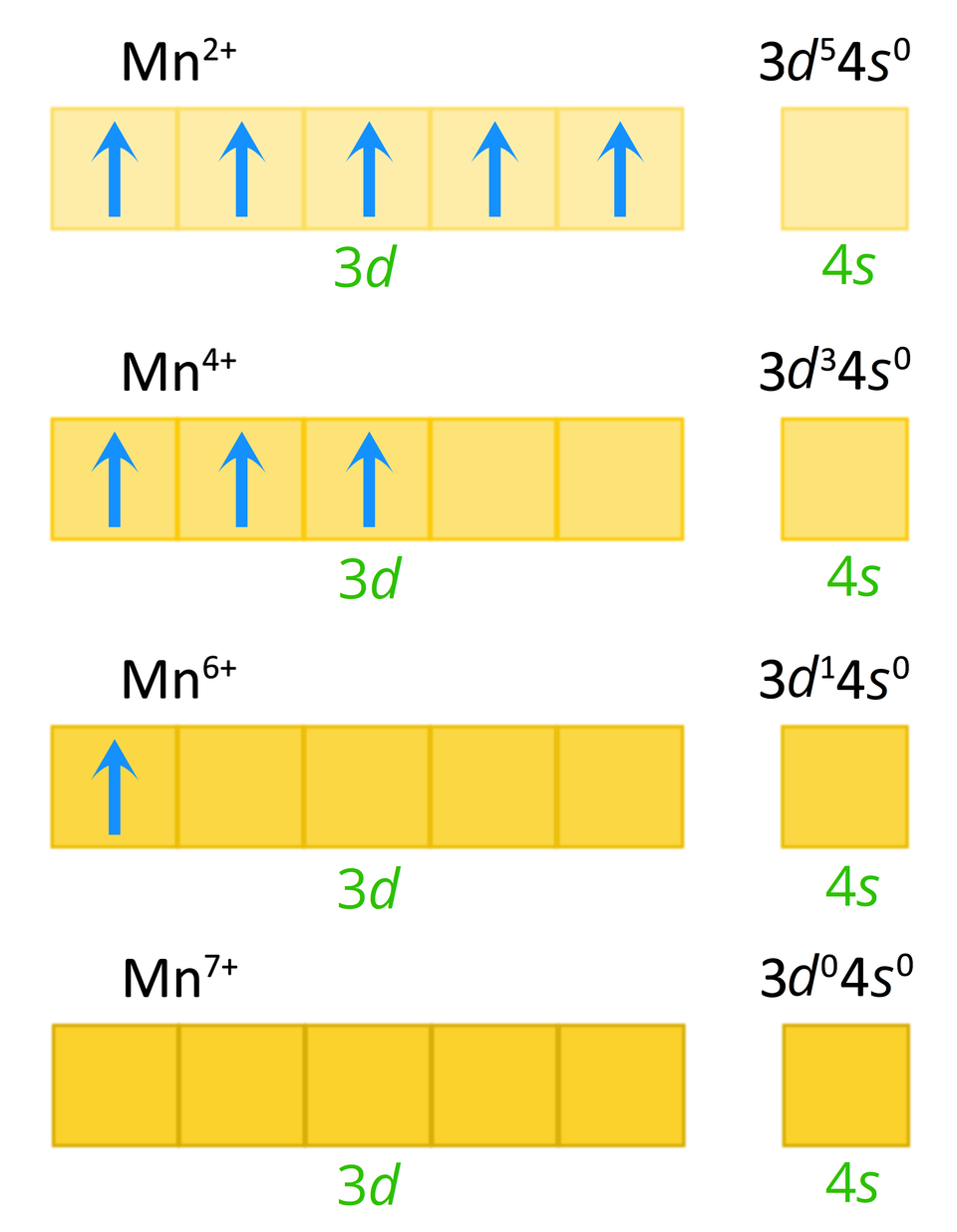
Wśród trwałych stopni utlenienia manganu, najczęściej spotykane są stopnie , , i . Zapisz w formie graficznej (tzw. zapis klatkowy) rozmieszczenie elektronów walencyjnych dla wymienionych stopni utlenienia atomu manganu w stanie podstawowym.