Sprawdź się
Korzystając z szeregu elektrochemicznego metali, wybierz prawidłowe stwierdzenia.
![Ilustracja przedstawiająca szereg elektrochemiczny metali, który zawiera schematyczny opis elektrod oraz wartości ich potencjałów standardowych E0 wyrażonych w woltach [V]. Li / Li+ -3,04 wolta. Ca / Ca2+ -2,86 wolta. Mg / Mg2+ -2,36 wolta. Al / Al3+ -1,69 wolta. Mn / Mn2+ -1,18 wolta. Zn / Zn2+ -0,76 wolta. Cr / Cr3+ -0,74 wolta. Fe / Fe2+ -0,44 wolta. Cd / Cd2+ -0,40 wolta. Co / Co2+ -0,28 wolta. Ni / Ni2+ -0,26 wolta. Sn / Sn2+ -0,14 wolta. Pb / Pb2+ -0,14 wolta. H2 / 2 H+ 0,00 wolta. Bi / Bi3+ 0,32 wolta. Cu / Cu2+ 0,34 wolta. Ag / Ag+ 0,80 wolta. Hg / Hg2+ 0,85 wolta. Au / Au3+ 1,52 wolta.](https://static.zpe.gov.pl/portal/f/res-minimized/RdxJV7fZoBqqn/1679065938/pEF8RLQR5dMd6Bm7tOivsIm2oopG3uGo.png)
Korzystając z podanych informacji z szeregu elektrochemicznego metali, zaznacz prawidłowe stwierdzenia. Elektroda potencjał standardowy wynosi ; potencjał standardowy wynosi ; elektroda potencjał standardowy ; elektroda Mn/Mn2+ potencjał standardowy -1,18; elektroda potencjał standardowy wynosi ; elektroda potencjał standardowy wynosi .
luka do uzupełnienia luka do uzupełnienia
luka do uzupełnienia luka do uzupełnienia
Przeprowadzono doświadczenie, zilustrowane poniższym schematem:
Przeprowadzono doświadczenie. Zapoznaj się z opisem schematu.

Zapisz w formie jonowej i jonowej skróconej równanie zachodzącej reakcji. Sformułuj wniosek do tego doświadczenia.
Równania reakcji:
Przeprowadzono następujące doświadczenia chemiczne, zgodne z rysunkiem poniżej:
Przeprowadzono doświadczenia chemiczne. Zapoznaj się z opisem rysunku.
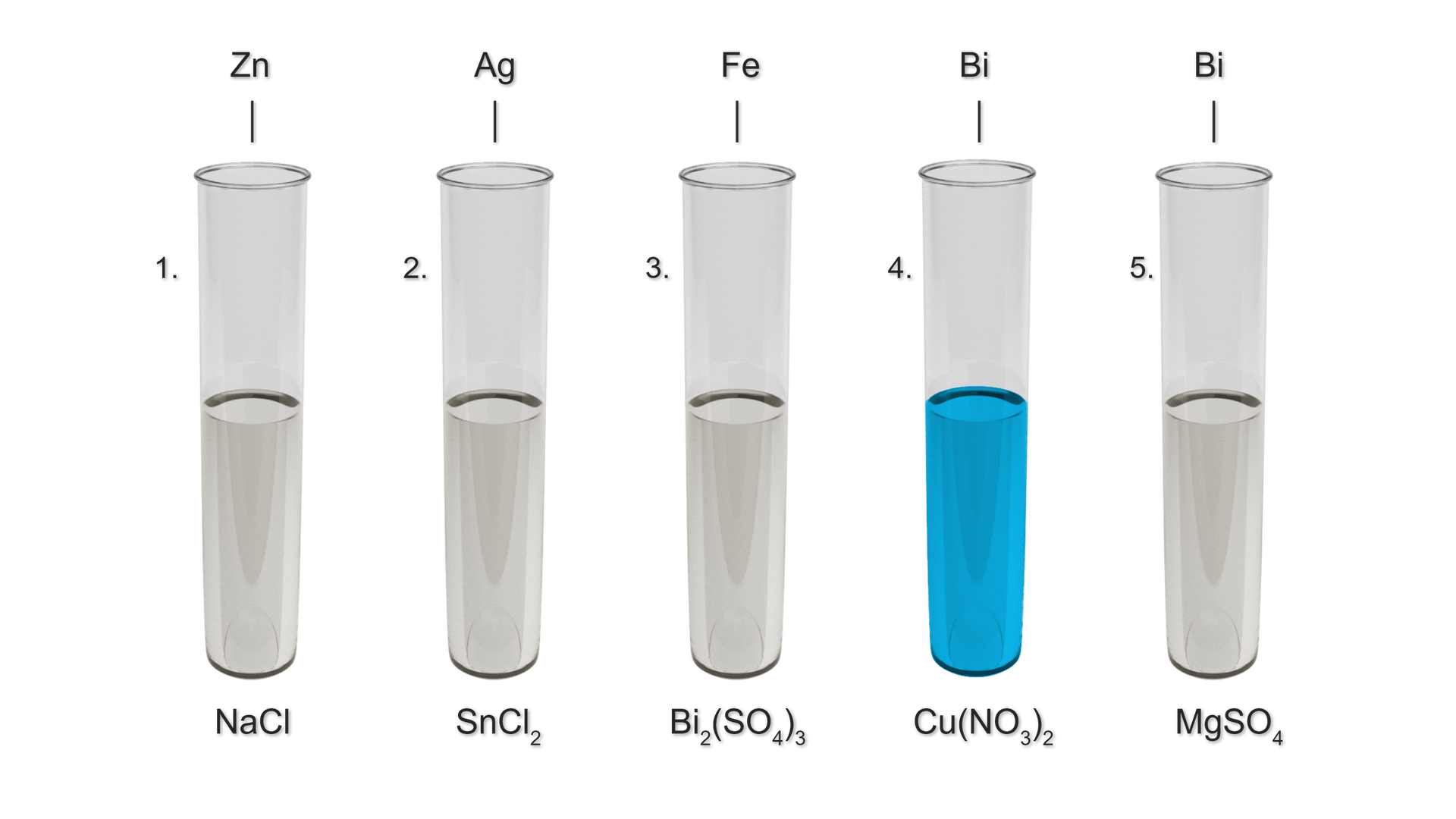
W których probówkach zajdą reakcje chemiczne? Zapisz równania tych reakcji w formie jonowej skróconej.
Kasia, w celu porównania aktywności wybranych metali, przeprowadziła kilka doświadczeń. Po ich wykonaniu przygotowała notatkę:
Korzystając z powyższych informacji, wskaż odpowiedź, która przedstawia uszeregowanie metali według ich wzrastającej aktywności.
Zaprojektuj doświadczenie, w którym wykażesz, że ołów jest metalem mniej aktywnym od kadmu. W tym celu uzupełnij puste pola w poniższym dzienniku laboratoryjnym.
Schemat doświadczenia:
Równania reakcji chemicznych – zapis cząsteczkowy:
