Stężenie procentowe a rozpuszczalność substancji
Interpretacja krzywych rozpuszczalności oraz stosowne obliczenia pozwalają przewidzieć masę substancji, która wydzieli się z roztworu nasyconego podczas jego oziębiania. Można także wyznaczyć masę rozpuszczalnika, którego należy dodać do wskazanego roztworu, aby otrzymać odpowiednie stężenie substancji rozpuszczonej. Możliwe jest też ustalenie stężenia procentowego roztworu nasyconego w danej temperaturze. W tym module będziemy dokonywać tego typu obliczeń.

że rozpuszczalność w wodzie wyrażana jest jako maksymalna liczba gramów substancji, która rozpuszcza się w 100 g wody w danej temperaturze i pod określonym ciśnieniem (ciśnienie bierze się pod uwagę w przypadku roztworów gazów, np. tlenu w wodzie, a gdy substancją rozpuszczoną są ciała stałe lub ciecze, ciśnienie ma niewielkie znaczenie i można je pominąć);
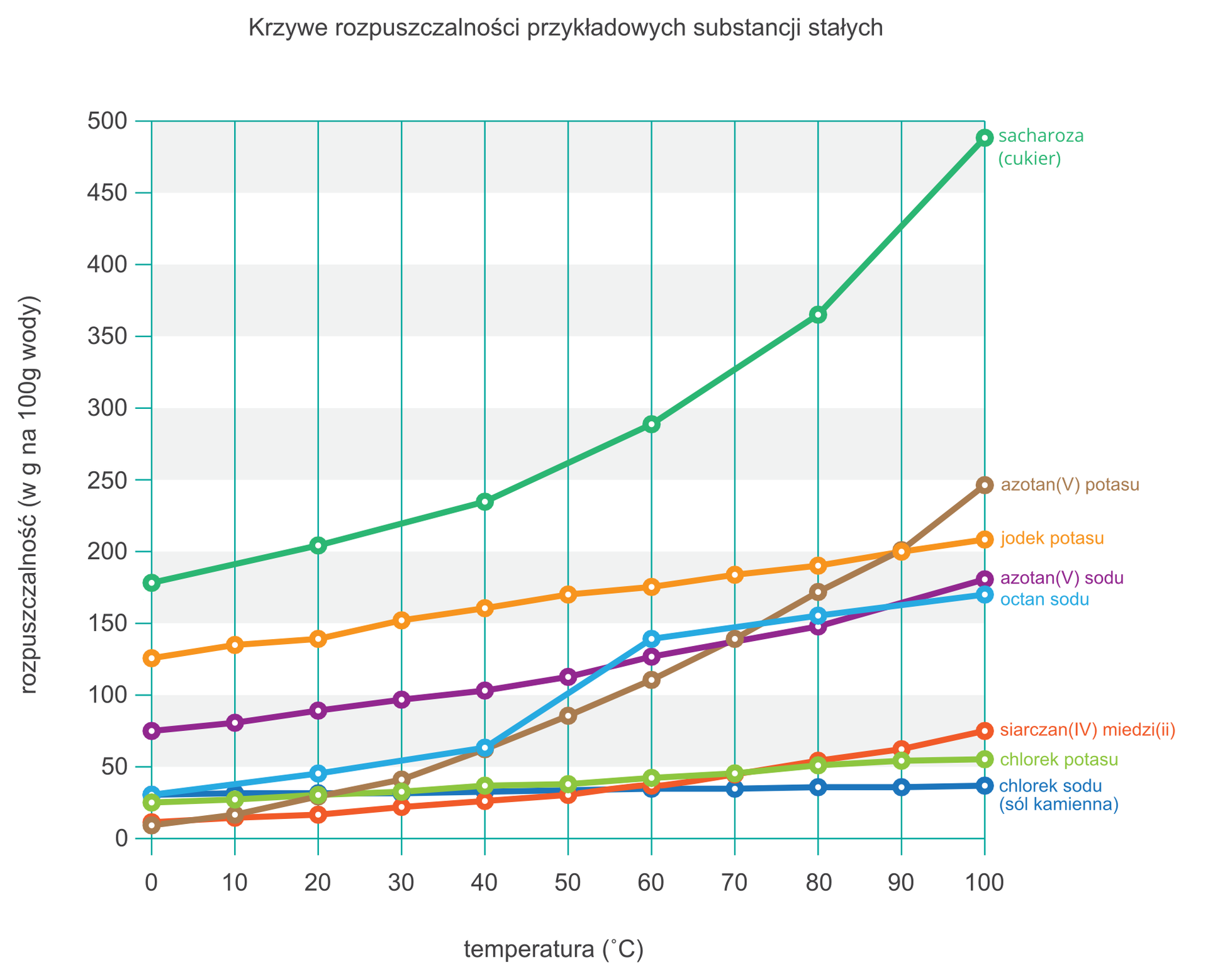
że wykres przedstawiający zależność rozpuszczalności danej substancji od temperatury nazywa się krzywą rozpuszczalności;
że stężenie procentowe określa liczbę gramów substancji rozpuszczonej znajdującej się w 100 gramach roztworu i można je obliczyć ze wzoru: .
obliczać stężenie procentowe roztworu nasyconego w ustalonej temperaturze;
wyznaczać rozpuszczalność roztworu na podstawie stężenia procentowego roztworu nasyconego w danej temperaturze.
1. Jak obliczamy stężenie procentowe roztworu nasyconego?
Roztwór nasycony w danej temperaturze zawiera określoną ilość substancji rozpuszczonej w określonej masie rozpuszczalnika. Na podstawie tych wielkości można obliczyć stężenie procentowe roztworu.
Wielkość | Rozpuszczalność | Masa roztworu | Stężenie procentowe |
znaczenie | maksymalna masa substancji jaką można rozpuścić w 100 g wody w danej temperaturze |

Oblicz, jakie stężenie procentowe ma nasycony roztwór siarczanu(VI) miedzi(II) w temperaturze 80°C.
Który roztwór nasycony ma większe stężenie procentowe: chlorek sodu w temperaturze 50°C czy azotan(V) sodu w temperaturze 10°C? Dokonaj właściwych obliczeń, które pozwolą odpowiedzieć na to pytanie.
Im więcej masy substancji rozpuszczonej przypada na określoną masę rozpuszczalnika, tym stężenie procentowe roztworu jest większe. Z uwagi na to, że zazwyczaj rozpuszczalność substancji stałych rośnie wraz z temperaturą, rośnie też stężenie roztworu nasyconego tych substancji.
2. Jak obliczamy rozpuszczalność substancji w nasyconym roztworze o znanym stężeniu procentowym?
Jeśli w danej temperaturze znamy stężenie procentowe nasyconego roztworu jakiejś substancji, to możemy obliczyć rozpuszczalność tej substancji w określonej temperaturze.
Oblicz rozpuszczalność substancji w temperaturze 50°C, jeśli roztwór nasycony w tej temperaturze ma stężenie równe 53,27%.
3. Otrzymywanie roztworów nasyconych z roztworów rozcieńczonych o określonym stężeniu procentowym
Z roztworów rozcieńczonych można uzyskać roztwory nasycone przez zatężanie, np. poprzez odparowanie rozpuszczalnika. Po osiągnięciu stanu nasycenia dalsze zatężanie roztworu będzie prowadzić do wydzielania się substancji rozpuszczonej z roztworu.
Oblicz, ile gramów wody należy odparować z 340 g roztworu chlorku sodu o stężeniu 1%, aby otrzymać nasycony roztwór tej substancji w temperaturze 20°C.
Oblicz, ile gramów chlorku potasu należy dodać do 120 g 5‑procentowego roztworu tej substancji, aby po rozpuszczeniu uzyskać roztwór nasycony w temperaturze 40°C.
4. Rozcieńczanie roztworów nasyconych w celu otrzymania roztworu o określonym stężeniu procentowym
W roztworach nasyconych podczas rozcieńczania zmienia się masa rozpuszczalnika (zwiększa się) w stosunku do masy substancji rozpuszczonej (która pozostaje niezmienna).
Oblicz, ile gramów wody należy dodać do 250 g nasyconego w temperaturze 10°C roztworu jodku potasu, aby uzyskać roztwór 10‑procentowy.
5. Zmiana temperatury roztworu
Zastanów się i odpowiedz, czy ogrzanie roztworu lub jego oziębienie spowodują zmianę stężenia procentowego i rozpuszczalności substancji w wodzie.
Rozpuszczalność ciał stałych w wodzie rośnie na ogół wraz ze wzrostem temperatury, a maleje wraz z jej obniżaniem się. Z tego względu podczas ochładzania roztworu nasyconego część substancji rozpuszczonej wydziela się w postaci osadu. Znając wartość rozpuszczalności substancji w dwóch różnych temperaturach, można określić ilość substancji, jaka wydzieli się podczas oziębiania dowolnej masy roztworu nasyconego.
Oblicz, ile gramów azotanu(V) potasu wydzieli się z roztworu nasyconego w temperaturze 100°C podczas oziębienia go do temperatury 10°C. Nasycony w temperaturze 100°C roztwór tej substancji został utworzony przez rozpuszczenie odpowiedniej ilości azotanu(V) potasu rozpuszczonej w 200 g wody.
400 g roztworu chlorku potasu o stężeniu 35% ochłodzono do temperatury 10°C. Oceń, czy po ochłodzeniu wydzielą się kryształy tej substancji z roztworu. Jaka będzie masa?
Podsumowanie
Na podstawie znajomości rozpuszczalności substancji można obliczyć stężenie procentowe roztworu nasyconego.
Wiedząc, jakie jest stężenie procentowe nasyconego roztworu substancji, można obliczyć jej rozpuszczalność.
Narysuj wykres przedstawiający zależność stężenia procentowego od rozpuszczalności w zakresie temperatur od 0°C do 100°C dla wybranej substancji.
Zadania
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
rośnie, maleje, objętości roztworu, nie mają jednakowego stężenia procentowego, rozpuszczalności substancji w danej temperaturze, temperatury roztworu, mają jednakowe stężenie procentowe, niższe, nie zmienia się, wyższe
Do obliczenia stężenia procentowego roztworu nasyconego konieczna jest informacja na temat .....................................................................................................
Im większa rozpuszczalność substancji, tym stężenie procentowe roztworu nasyconego jest .....................................................................................................
Stężenie procentowe wodnych roztworów nasyconych większości gazów .................................................................................................... wraz z temperaturą.
W danej temperaturze roztwory nasycone różnych substancji .....................................................................................................
Oblicz, jakie stężenie procentowe ma nasycony roztwór siarczanu(VI) miedzi(II) w temperaturze 60°C. Wskaż prawidłową odpowiedź.
Rozpuszczalność siarczanu(VI) miedzi(II) w temperaturze 60°C wynosi 40 g w 100 g wody.
- 28,6%
- 40,0%
- 22,2%
- 60,0%
Określ stężenie procentowe nasyconego roztworu kwasu askorbinowego (witaminy C) w temperaturze 80°C, jeśli jego rozpuszczalność w tej temperaturze wynosi 50,47 g w 100 g wody. Wskaż prawidłową odpowiedź.
- 33,54%
- 50,47%
- 49,53%
- 0,335%
- 32,91%
Oblicz stężenie procentowe nasyconego roztworu cukru w temperaturze 60°C. Wskaż prawidłową odpowiedź.
Rozpuszczalność cukru w temperaturze 60°C wynosi 288 g cukru w 100 g wody.
- 74,2%
- 2,88%
- 0,74%
- 65,2%
- 1,88%
Uporządkuj roztwory nasycone według rosnącego stężenia procentowego:
– roztwór chlorku sodu w temperaturze 90°C,
- roztwór chlorku potasu w temperaturze 70°C,
- roztwór azotanu(V) potasu w temperaturze 30°C,
– roztwór azotanu(V) sodu w temperaturze 0°C.
Wykonując obliczenia, skorzystaj z wykresu krzywych rozpuszczalności.
- roztwór chlorku sodu
- roztwór azotanu(V) potasu
- roztwór azotanu(V) sodu
- roztwór chlorku potasu
Oblicz rozpuszczalność substancji, jeśli stężenie procentowe nasyconego roztworu wynosi 20%.
- 25 g substancji w 100 g wody
- 20 g substancji w 100 g wody
- 80 g substancji w 100 g wody
- 400 g substancji w 100 g wody
- 120 g substancji w 100 g wody
Oblicz, ile gramów cukru należy dodać do 280 g roztworu tej substancji o stężeniu 40%, aby po rozpuszczeniu uzyskać roztwór nasycony w temperaturze 20°C.
Rozpuszczalność cukru w temperaturze 20°C wynosi 204 g cukru w 100 g wody.
- 230,7 g
- 112,0 g
- 342,7 g
- 204,0 g
- 24,0 g
Oblicz, ile gramów wody należy odparować z 1500 g 20-procentowego roztworu cukru, aby otrzymać nasycony roztwór tej substancji w temperaturze 0°C.
Rozpuszczalność cukru w temperaturze 0°C wynosi 179 g cukru w 100 g wody.
- 1032,4 g
- 2148 g
- 1200 g
- 178,9 g
- 1679 g
Oblicz, ile gramów wody należy dodać do 90 g nasyconego w temperaturze 50°C roztworu chlorku sodu, aby uzyskać roztwór o stężeniu 9%.
Rozpuszczalność chlorku sodu w temperaturze 50°C wynosi 37 g w 100 g wody.
- 180,0 g
- 65,7 g
- 245,7 g
- 155,7 g
- 24,3 g
Oblicz, ile gramów jodku potasu wydzieli się z roztworu nasyconego w temperaturze 100°C podczas oziębiania go do temperatury 20°C. Nasycony w temperaturze 100°C roztwór tej substancji został utworzony przez rozpuszczenie odpowiedniej ilości jodku potasu w 200 g wody. Wskaż prawidłową odpowiedź.
- 128 g
- 100 g
- 208 g
- 144 g
- 74 g


