Właściwości substancji
Zimą do spryskiwaczy i chłodnic samochodowych wlewa się specjalne płyny, które zamarzają w temperaturze poniżej –20°C, a nawet –37°C. Do szlifowania i polerowania kamieni szlachetnych, a także do cięcia szkła używa się diamentu, który jest jednym z najtwardszych materiałów. Jak widać, zastosowania substancji są związane z ich cechami charakterystycznymi, takimi jak np. temperatura krzepnięcia lub twardość. Zastanów się, jakie inne właściwości mają substancje nas otaczające i w jaki sposób można je wykorzystywać.
czym zajmuje się chemia;
jakie zasady bezpieczeństwa obowiązują w szkolnej pracowni chemicznej;
których naczyń i jakiego sprzętu należy użyć do wykonania określonej czynności laboratoryjnej;
jak należy postępować z substancjami i preparatami oznaczonymi piktogramami ostrzegawczymi.
definiować pojęcie substancja;
określać, które cechy substancji są zaliczane do właściwości fizycznych, a które – do właściwości chemicznych;
planować metody badania właściwości fizycznych i chemicznych substancji;
badać i opisywać właściwości wybranych substancji.
1. Czy słowo substancja ma zawsze takie samo znaczenie?
W języku potocznym substancjami nazywamy otaczające nas elementy przyrody, np. wodę, powietrze, drewno do palenia w kominku, a także używane w kuchni przyprawy. Jednak nie jest to określenie poprawne pod względem chemicznym.
SubstancjaSubstancja to rodzaj materii o stałym składzie chemicznym, wykazującej zespół określonych właściwości, dzięki którym możemy ją rozpoznać.
Substancjami są np: cukier, sól kamienna, żelazo, tlen, czysta woda, czyli tzw. woda destylowana (w przeciwieństwie do wody morskiej czy też z kranu).
Czy zastosowanie różnych przedmiotów związane jest z właściwościami materiałów, z których są wykonane?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Zastosowanie przedmiotów jest związane z właściwościami materiałów, z których są wykonane.
Zastosowanie przedmiotów nie jest związane z właściwościami materiałów, z których zostały one wykonane.
nóż drewniany (do smarowania),
nóż plastikowy,
metalowy nóż kuchenny,
deska do krojenia,
jabłko.
Połóż jabłko na desce.
Spróbuj przekroić je kolejno nożami wykonanymi z różnych materiałów (drewna, plastiku i metalu).
Obserwacje
Najłatwiej jabłko kroi się nożem metalowym, a najtrudniej – drewnianym.
Wniosek
Każda substancja, z której wytworzono określony przedmiot, ma inne właściwości. Dlatego do przekrojenia jabłka najlepiej użyć noża metalowego, a nie plastikowego czy drewnianego. Dobre do krojenia, ostre noże produkuje się m.in. z dobrej jakości twardego metalu lub jego stopu. Sztućce jednorazowego użytku wytwarza się z taniego plastiku, zaś noże, które świetnie nadają się do smarowania pieczywa, wykonuje się z drewna.
Użyteczność przedmiotów jest związana z właściwościami materiałów, z których są wykonane.
Elementy konstrukcyjne wytwarza się z materiałów o dużej wytrzymałości. Garnki wykonuje się z tworzyw, które dobrze przewodzą ciepło, zaś rączki – z izolatorów chroniących przed oparzeniem. Dobre i złe przewodnictwo ciepła to właściwości materii, które wpływają na jej zastosowanie. Niektóre cechy można zmierzyć, inne – tylko opisać. Pomiarów dokonuje się w tych samych warunkach (w temperaturze pokojowej i pod ciśnieniem normalnym), co umożliwia porównanie ich wyników.
Przypomnij sobie z lekcji przyrody, z czego zbudowany jest otaczający nas świat.
Spójrz na ilustracje przykładowych wyrobów (waty cukrowej, szpilki krawieckiej, solnego żyrandola, srebrnej monety, miedzianej rynny) i określ, z jakich substancji zostały wytworzone.
2. Jakie właściwości nazywamy fizycznymi?
Wszystkie substancje mają określone właściwości. Możemy je badać zmysłami (np. zobaczyć, usłyszeć, powąchać) lub za pomocą specjalnych przyrządów, co pozwala odróżnić daną substancję od innej.
Właściwości substancji możemy podzielić na:
jakościowe – te, których nie można wyrazić w liczbach (np. smak, zapach);
ilościowe – te, które można mierzyć i opisać za pomocą liczb (np. gęstość, temperatura wrzenia, temperatura topnienia).
Jakie znasz stany skupienia?
Przypomnij z lekcji przyrody wiadomości o stanach skupienia wody.
Rozejrzyj się wokół siebie i dokonaj podziału przedmiotów, biorąc pod uwagę ich stan skupienia.
Substancje mogą występować (w określonej temperaturze i przy odpowiednim ciśnieniu) w jednym z trzech podstawowych stanów skupienia:
stałym,
ciekłym,
gazowym.
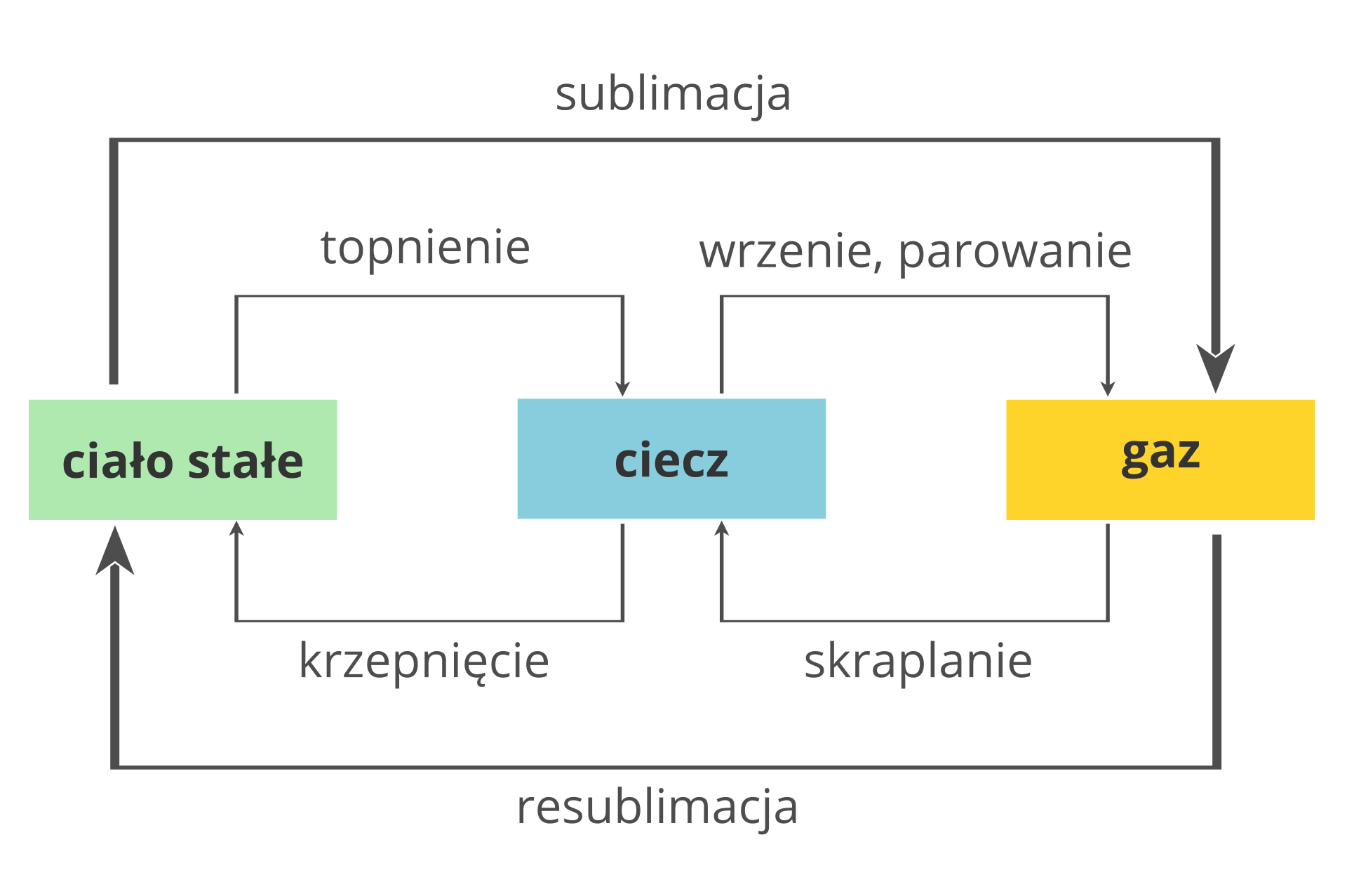
Substancje mogą zmieniać stan skupienia w określonej temperaturze. Przyjrzyjmy się temu zjawisku na przykładzie wody.
Lód topi się, czyli przechodzi ze stanu stałego w ciekły w temperaturze 0°C. Mówimy, że jest to temperatura topnienia (krzepnięcia) wody.
Woda wrze, czyli przechodzi ze stanu ciekłego w gazowy, w temperaturze 100°C – mówimy, że jest to temperatura wrzenia wody.
Wszystkie te zmiany można odwrócić, wystarczy ogrzać lub oziębić wodę.
Niekiedy substancja stała przekształca się bezpośrednio w gaz z pominięciem stanu ciekłego (sublimacja) i odwrotnie – gaz może bezpośrednio przejść w stan stały, bez skraplania i krzepnięcia (resublimacja).
Czwarty stan skupienia
Definicja uwzględniająca tylko trzy stany skupienia uległa zmianie, kiedy to w 1928 r. Irving Langmuir (czyt. erwing lanmire) wprowadził pojęcie plazma.
Na Ziemi plazma występuje rzadko, można ją zaobserwować podczas wyładowań atmosferycznych, np. podczas burzy lub w zorzy polarnej. Natomiast we Wszechświecie plazma jest najczęściej występującym stanem materii. Są z niej zbudowane niektóre gwiazdy, np. Słońce. Techniczne zastosowanie plazmy jest szerokie, najbardziej znane produkty, w których wykorzystuje się plazmę, to telewizory z ekranem plazmowym (PDP – od ang. plasma display panel), świetlówki oraz neonówki.
Piąty stan skupiena
W latach 20. XX wieku fizycy Satyendra Bose (czyt. satiendra bos) i Albert Einstein (czyt. ensztain) przewidzieli istnienie piątego stanu skupienia materii – kondensatu Bosego‑Einsteina (nazwa pochodzi od ich nazwisk). Za prace nad stworzeniem takiego kondensatu oraz podstaw wiedzy na ten temat Nagrodę Nobla w 2001 roku w dziedzinie fizyki otrzymali Eric Cornell (czyt. erik kornel), Carl Wieman (czyt. karl łiman) (USA), Wolfgang Ketterle (czyt. keterle) (Niemcy). Kondensat Bosego‑Einsteina powstaje przez chłodzenie rozrzedzonego gazu atomów do bardzo niskiej temperatury. Badania nad kondensatem mogą przyczynić się m.in. do stworzenia komputerów o dużej mocy obliczeniowej i małych rozmiarach, bardzo precyzyjnych miniaturowych zegarów atomowych, a także mogą wpłynąc na rozwój nanotechnologii.
Zero absolutne
W drugiej połowie XIX w. fizycy odkryli, że temperatura jest przejawem chaotycznego ruchu cząstek, z których składa się materia. W substancjach stałych cząstki drgają, w cieczach – przemieszczają się swobodnie we wszystkich kierunkach, zderzając się ze sobą niczym kule bilardowe, a w gazach – poruszają się swobodnie we wszystkich kierunkach.
Zero absolutne, bezwzględne (0 kelvinów równe co do wartości –273,15°C) to taka temperatura, w której cząstki nieruchomieją, przestają się przemieszczać, drgać i obracać, mają najniższą możliwą energię.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1EuVH84U
Czy badana materia w tych samych warunkach może zachowywać się jednocześnie jak ciecz i substancja stała (mieć właściwości cieczy i substancji stałej)?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Badana materia w tych samych warunkach nie może mieć właściwości cieczy i substancji stałej.
Badana materia w tych samych warunkach może mieć właściwości cieczy i substancji stałej.
krystalizator lub głęboki talerz,
szklanka,
skrobia ziemniaczana (mąka ziemniaczana),
woda.
Do krystalizatora (lub głębokiego talerza) wsyp ok. ½ szklanki mąki ziemniaczanej. Dodaj ¼ szklanki wody.
Następnie, cały czas mieszając, stopniowo dolewaj wodę aż do momentu uzyskania cieczy o konsystencji bardzo gęstego płynu.
Zbadaj zachowanie powstałej masy poprzez:
zanurzenie ręki (szybko, wolno),
uderzenie pięścią,
nabranie niewielkiej ilości masy w dłonie i uformowanie kuli,
wrzucenie uformowanej wcześniej kuli do miski z masą,
potrząśnięcie zawartością krystalizatora (talerza).
Otrzymana w wyniku doświadczenia masa zachowuje się albo jak ciecz (substancja płynna), albo jak substancja stała – w zależności od siły, z jaką na nią działamy. Badana materia w tych samych warunkach może mieć właściwości zarówno cieczy, jak i substancji stałej. To tzw. ciecz nienewtonowska (płyn nienewtonowski).

Film dostępny na portalu epodreczniki.pl
Animacja prezentująca zmianę stanu skupienia i zależności między ułożeniem cząsteczek wody i mąki ziemniaczanej.
Właściwości fizyczneWłaściwości fizyczne – cechy charakterystyczne substancji:
stan skupienia;
barwa;
rodzaj powierzchni: błyszcząca, matowa, chropowata, porowata;
twardość;
zmiana kształtu ciała pod wpływem sił:
kruchość (odkształcenie trwałe z rozpadem na mniejsze kawałki);
sprężystość (zmiana kształtu pod wpływem niewielkiej siły i powrót do pierwotnego kształtu);
kowalność (odkształcenie trwałe metali, ale bez rozpadu na mniejsze kawałki);
rozpuszczalność w wodzie i innych rozpuszczalnikach (ciekłych, stałych i gazowych);
przewodnictwo ciepła;
przewodnictwo prądu elektrycznego;
właściwości magnetyczne;
temperatura wrzenia;
temperatura topnienia;
gęstość.


Znajdź podobieństwa i różnice we właściwościach fizycznych 3 dowolnych substancji: porównaj ich barwy, stan skupienia, rozpuszczalność w wodzie. Zaplanuj doświadczenie, przeprowadź je, a obserwacje i wnioski zanotuj w zeszycie.
W jaki sposób można zidentyfikować właściwości fizyczne substancji i ich mieszanin?
Właściwości fizyczne substancji i ich mieszanin można zidentyfikować za pomocą zmysłów, np. wzroku.
sól kamienna,
cukier,
mąka,
kawałek kredy,
woda,
miedziany drut,
żelazna szpilka krawiecka,
7 szalek Petriego,
7 zlewek,
bagietka.
Na 5 szalkach Petriego umieść kolejno po łyżeczce: soli kamiennej, cukru, mąki, rozdrobnionej kredy, wody. Na 6. szalce połóż kawałek miedzianego drutu, a na 7. – żelazną szpilkę krawiecką.
Określ stan skupienia oraz barwę badanych substancji.
Do zlewek wlej wodę do połowy ich objętości, dodaj badane substancje z szalek Petriego i zamieszaj bagietką. Określ rozpuszczalność substancji w wodzie.
Obserwacje potrzebne do doświadczenia przedstaw w formie tabeli.
Substancja | Stan skupienia | Barwa | Rozpuszczalność w wodzie |
Wydrukuj i wypełnij formularz.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna ujęcie laborantki sprawdzającej zapach próbek trzech różnych substancji na szalkach Petriego. Robi to prawidłowo, czyli bez przykładania nosa do próbek, lecz przez wachlowanie ręką od naczynia w kierunku swojej twarzy. Następuje zmiana ujęcia na zbliżenie wszystkich czterech próbek: soli kamiennej, siarki i żelaza. Pojawia się napis Rozpuszczalność badanych substancji w wodzie. Laborantka demonstrująca zagadnienie dodaje do trzech zlewek z wodą kolejno sól kamienną, żelazo i siarkę, mieszając za każdym razem bagietką. Pojawia się napis Próba twardości różnych substancji. Następują ujęcia uderzeń młotka rozbijającego kawałki soli kamiennej i siarki. Uderzenia młotkiem w żelazną płytkę nie dają żadnych widocznych efektów. Pojawia się napis Badanie właściwości magnetycznych substancji. Następuje ujęcie zbliżania magnesu najpierw do żelaza, następnie do soli, a na koniec do siarki. Tylko żelazo zostaje przyciągnięte. Pojawia się napis Badanie przewodnictwa elektrycznego. Do próbek soli, siarki i żelaza przyłożone zostają końcówki przyrządu pomiarowego ustawionego na badanie oporu. Tylko przy żelazie następuje reakcja - wyświetlacz wskazuje opór bliski zerowemu, a więc pełne przewodnictwo prądu. Pojawia się napis Podsumowanie, a następnie krótkie migawki z wcześniej przeprowadzanych prób.

Film dostępny na portalu epodreczniki.pl
Film rozpoczyna ujęcie czterech zlewek z przezroczystymi płynami, z których jeden ma żółtawy kolor. Zgodnie z podpisami płyny te to, licząc od lewej, woda, olej, gliceryna i ocet. Demonstrator dolewa po niewielkiej ilości trzech ostatnich substancji do zlewek z wodą i miesza. Ocet rozpuszcza się w wodzie natychmiast, natomiast gliceryna rozpuszcza się zaraz po wymieszaniu. Olej mimo mieszania nie rozpuszcza się w wodzie, lecz tworzy warstwę na jej powierzchni.
Na początku XVIII w. pochodzący z Gdańska holenderski inżynier Daniel Fahrenheit, wzorując się na duńskim astronomie Olem Romerze, wynalazł termometr rtęciowy. Ole Romer (czyt. ule roma) za temperaturę wrzenia wody przyjął 60 stopni, zgodnie z systemem sześćdziesiątkowym, w którym liczą się także czas i kąty (podział na sekundy i minuty). Według tej skali woda zamarza w 7,5 stopnia, a temperatura ciała ludzkiego wynosi 22,5 stopnia.
Daniel Fahrenheit (czyt. farenhait), który nie lubił ułamków, najpierw pomnożył stopnie Romera przez cztery, a potem jeszcze nieco zmienił, żeby różnica między zerem a temperaturą ludzkiego ciała była równa 64 stopniom. Umożliwiło mu to podzielenie jednego odcinka wielokrotnie na pół (64 to 26) i zrobienie podziałki w swoich termometrach. Tak oto temperatura zamarzania wody w skali Fahrenheita ma wartość 32, a wrzenia – 212 stopni. Amerykanie używają tej skali do dziś. Europejczycy korzystają ze skali szwedzkiego astronoma i fizyka Andersa Celsiusa(czyt. andesz celsios), w której 0 stopni to temperatura topnienia lodu, a 100 stopni – temperatura wrzenia wody.

3. Jakie właściwości nazywamy chemicznymi?
Obejrzyj fotografie. Obie drabiny przez kilka miesięcy były narażone na działanie podobnych warunków atmosferycznych.
Zastanów się, jakimi właściwościami różnią się substancje, z których wykonano obie drabiny.

Właściwościami chemicznymiWłaściwościami chemicznymi nazywamy te cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji. Są to np.:
zapach,
smak,
palność,
reaktywność (zdolność do reagowania z określonymi substancjami lub jej brak, uleganie rozkładowi na substancje prostsze pod wpływem określonych czynników).

Czy substancje ulegają spalaniu w ten sam sposób?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Badane substancje spalają się w ten sam sposób.
Badane substancje mogą różnić się palnością.
magnez,
miedź,
palnik,
szczypce metalowe,
okulary ochronne.
Metalowymi szczypcami chwyć niewielki kawałek wstążki magnezowej i umieść go w płomieniu palnika. Obserwuj zachodzące zmiany.
Metalowymi szczypcami chwyć niewielki kawałek miedzianego drutu i umieść go w płomieniu palnika. Obserwuj zachodzące zmiany.
RjfON0EeH9MLh1  Źródło: Søren Wedel Nielsen (https://commons.wikimedia.org), licencja: CC BY-SA 3.0.
Źródło: Søren Wedel Nielsen (https://commons.wikimedia.org), licencja: CC BY-SA 3.0.
Obserwacje: magnez szybko spala się oślepiającym białym płomieniem. Natomiast długo ogrzewana miedź pokrywa się nalotem o czarnej barwie.
Wnioski: badane substancje różnią się pod względem palności.

Film dostępny na portalu epodreczniki.pl
Zbliżenie na dwie kolby stożkowe zamknięte korkami. Podpis pod lewą: tlen. Podpis pod prawą: tlenek węgla(IV). Laborantka przeprowadzająca demonstrację otwiera po kolei na moment kolby, przeprowadzając próbę zapachową, po czym zamyka je z powrotem. Pojawia się plansza z napisem Badanie palności. Kolba z tlenem ponownie zostaje otwarta, a do jej wnętrza wprowadzane zostaje żarzące się łuczywko, które natychmiast rozpala się jasnym płomieniem. Po przełożeniu do kolby z dwutlenkiem węgla, łuczywko gaśnie. Nagranie zostaje spauzowane, a ekranie pojawia się napis Wnioski.

Film dostępny na portalu epodreczniki.pl
Widoczny schemat opisujący etapy eksperymentu. Zbliżenie na pole Określenie problemu badawczego. Przejazd kamery na Stawianie hipotezy. Przejazd na Wybór metody badawczej. Ujęcie stołu laboratoryjnego o zawartości (odczynniki i sprzęt) zgodnej z czytanym komentarzem: na szalkach Petriego znajdują się miedź, żelazo, cukier, sól kuchenna, mąka; w kolbie zebrany i zakorkowany chlor. Oprócz tego woda w czterech zlewkach, łyżka bagietka, młotek i szczypce. Ujęcie fragmentu schematu Przeprowadzenie doświadczenia. Przebieg doświadczenia: określanie kolejnych właściwości substancji (miedzi, żelaza, soli kamiennej, cukru, mąki, wody, chloru): stanu skupienia, barwy (zbliżenie na substancję), twardości (uderzanie młotkiem) oraz innych cech charakterystycznych, rozpuszczalności w wodzie poprzez wsypywanie substancji do zlewki i mieszanie bagietką. Następnie ujęcie tabeli z zebranymi właściwościami badanych substancji. Na koniec ujęcie planszy Wynik potwierdza hipotezę.
Znajdź podobieństwa i różnice właściwości chemicznych 3 dowolnych substancji: pod nadzorem nauczyciela porównaj ich smak i zapach. Zaplanuj doświadczenie, przeprowadź je, a obserwacje i wnioski zanotuj w zeszycie.
W jaki sposób możemy określić właściwości chemiczne substancji i ich mieszanin?
Właściwości chemiczne substancji i ich mieszanin można określić za pomocą zmysłów, np. powonienia.
woda,
10‑procentowy kwas octowy (ocet),
aceton (zmywacz do paznokci zawierający aceton),
3 zlewki,
sól kamienna,
karmel,
2 szalki Petriego.
Do pierwszej zlewki wlej niewielką ilość wody, do drugiej – trochę octu, do trzeciej – zmywacz do paznokci.
Ostrożnie zbadaj zapach (wachlując dłonią, skieruj pary substancji w stronę nosa).
Na pierwszej szalce umieść sól kamienną, na drugiej – karmel. Zbadaj ich zapach.
Obserwacje
Woda i sól kamienna są bezwonne. Ocet i zmywacz do paznokci mają odmienne, charakterystyczne ostre zapachy, które pozwalają odróżnić jedną substancję od drugiej. Karmel ma specyficzny zapach.
Wniosek
Badane substancje różnią się zapachem.
Właściwości chemiczne substancji i ich mieszanin można określić za pomocą zmysłów, np. powonienia.
Ze względu na bezpieczeństwo w pracowni chemicznej smak wybranych substancji badamy wyłącznie na wyraźne polecenie nauczyciela.
W jaki sposób możemy zidentyfikować właściwości chemiczne substancji i ich mieszanin?
Właściwości chemiczne substancji i ich mieszanin można określić za pomocą zmysłów, np. smaku.
sól kamienna,
cukier,
woda,
talerz,
kubek jednorazowy,
łyżeczka jednorazowa.
Na talerz wsyp niewielką ilość soli kamiennej i cukru. Na czubku łyżeczki umieść niewielką ilość soli i zbadaj jej smak.
W ten sam sposób określ smak cukru.
Do kubka nalej wodę i zbadaj jej smak.
Obserwacje
Sól kamienna jest słona, cukier – słodki, a woda nie ma smaku.
Wniosek
Badane substancje różnią się smakiem.
Właściwości chemiczne substancji i ich mieszanin można zidentyfikować za pomocą zmysłów, np. smaku.
Podsumowanie
Świat składa się z różnych substancji, które mają stały skład i określone właściwości.
Każda substancja ma swoje właściwości fizyczne, np. stan skupienia, barwę, rozpuszczalność w wodzie, oraz chemiczne, np. smak, zapach, palność.
Substancje można zidentyfikować na podstawie ich właściwości.
Zastosowania substancji wynikają z ich charakterystycznych właściwości, zarówno fizycznych, jak i chemicznych (np. cukier jest słodki, dlatego używamy go do słodzenia, dwutlenek węgla nie podtrzymuje palenia, więc jest stosowany jako środek gaśniczy w niektórych rodzajach gaśnic).
Odszukaj w tablicach chemicznych wartości gęstości, temperatury topnienia i wrzenia złota, platyny oraz srebra, a następnie porównaj je ze sobą, zestawiając dane w tabeli.
Opisz właściwości czterech substancji z życia codziennego. Uwzględnij ich stan skupienia, barwę, rozpuszczalność w wodzie oraz zapach. Zestaw dane w tabeli.
Przedstaw w formie infografiki właściwości substancji z podziałem na właściwości fizyczne i chemiczne.
Słowniczek
właściwość charakteryzująca substancje stałe, np. metale, które pod wpływem kucia ulegają odkształceniu, tworząc cienkie blaszki, a nawet folie
właściwość substancji stałych lub materiałów, które pod wpływem uderzenia rozpadają się na małe kawałki
to liczba gramów substancji stałych, ciekłych i gazowych, które można rozpuścić w 100 gramach wody w danej temperaturze
rodzaj jednorodnej materii (o stałym składzie chemicznym) o określonych właściwościach (cechach charakterystycznych, np. stan skupienia, w danych warunkach, barwa, twardość, palność), np. woda, żelazo, miedź, glin
temperatura, w której substancja zmienia stan skupienia ze stałego na ciekły (topi się); temperatura topnienia zależy od ciśnienia w otoczeniu
temperatura, w której substancja zmienia stan skupienia z ciekłego na gazowy (wrze); im niższe jest ciśnienie atmosferyczne, tym niższa jest temperatura wrzenia cieczy
cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji; do właściwości chemicznych zaliczamy m.in.: palność, reaktywność, zapach, smak
charakterystyczne cechy danej substancji, takie jak: stan skupienia, barwa, rozpuszczalność (rozpuszczanie to zjawisko fizyczne), przewodnictwo elektryczne, przewodnictwo cieplne, temperatury wrzenia i topnienia, twardość, kruchość, kowalność, połysk, gęstość, właściwości magnetyczne
Zadania
Oceń prawdziwość każdego zdania. Zaznacz Prawda, jeśli zdanie jest prawdziwe, lub Fałsz, jeśli jest fałszywe.
| Prawda | Fałsz | |
| Substancja ma charakterystyczne właściwości, które umożliwiają jej identyfikację. | □ | □ |
| Stan skupienia materii to jedna z właściwości fizycznych substancji niezależna od temperatury i ciśnienia. | □ | □ |
| Właściwości chemiczne to cechy substancji, które można określić na podstawie jej zachowania wobec innych substancji. | □ | □ |
| Woda niezależnie od ciśnienia zawsze wrze w temperaturze 100 stopni Celsjusza, czyli przechodzi ze stanu ciekłego w gazowy. | □ | □ |

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1EuVH84U

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1EuVH84U
Przyjrzyj się fotografiom 1–4 i na ich podstawie określ w tabeli po jednej właściwości charakterystycznej dla każdej z substancji. Pamiętaj, że w każdym wierszu można zaznaczyć tylko jedną odpowiedź.
Uczniowie w grupach mieli zbadać właściwości wybranych substancji. Informacje z kart pracy zestawiono w tabeli. Która z grup określiła wyłącznie właściwości fizyczne?
Grupa I | Gaz, bezbarwny, bezwonny; ma gęstość najmniejszą spośród wszystkich gazów; podczas jego spalania powstaje woda. |
Grupa II | Ciało stałe, kruche; rozpuszczalne w wodzie; o gęstości 1,587 g/cm³ i temperaturze topnienia 184°C. |
Grupa III | Ciało stałe, bezwonne; barwy żółtej; nie przewodzi prądu elektrycznego; w reakcji ze srebrem tworzy substancję stałą o czarnej barwie. |
Grupa IV | Substancja stała, barwy czarnej; pod wpływem jej ogrzewania wydziela się m.in. woda. |
- Grupa II
- Grupa I
- Grupa III
- Grupa IV
Uczniowie w grupach badali przewodnictwo elektryczne wybranych substancji. Informacje zapisali w kartach pracy w postaci tabeli.
Substancja | Obserwacje |
siarka | żarówka nie świeci się |
cukier | żarówka nie świeci się |
mąka | żarówka nie świeci się |
sól | żarówka nie świeci się |
miedź | żarówka świeci się |
żelazo | żarówka świeci się |
Spośród odpowiedzi wybierz te, które są wnioskami z doświadczenia sformułowanymi na podstawie danych z tabeli.
- Miedź i żelazo przewodzą prąd.
- Żelazo najlepiej przewodzi prąd.
- Żelazo nie przewodzi prądu.
- Sól kamienna, cukier i mąka nie przewodzą prądu.
- Siarka najsłabiej przewodzi prąd.
- Miedź i żelazo są ciałami stałymi.
- Sól kamienna, cukier i mąka przewodzą prąd.