Symulacja interaktywna
Wiele substancji, w skład których wchodzą drobiny pierwiastków bloku , jest barwnych. Za pomocą poniższej symulacji sprawdź zabarwienia roztworów zawierających wybrane kationy metali bloku , w obecności ligandu słabo lub silnie rozszczepiającego . W tym celu uzupełnij zapis graficzny konfiguracji elektronowej danego jonu. Następnie sprawdź w jaki sposób odpowiedni ligand działa na elektrony położone w obrębie orbitali typu i ustal, w jaki sposób oddziaływanie to wpływa na obserwowaną barwę analizowanego roztworu. Kolejno rozwiąż zadania sprawdzające znajdujące się pod symulacją.
Wiele substancji, w skład których wchodzą pierwiastki bloku , jest barwnych. Zapoznaj się z opisem symulacji, w której zbadano zabarwienia roztworów zawierających związki tych pierwiastków na różnych stopniach utlenienia. Następnie rozwiąż poniższe zadania sprawdzające.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D15X7ADFM
Wspomnianą absorpcję promieniowania można wyjaśnić wykorzystując tzw. teorię pola krystalicznego. Teoria ta zakłada w uproszczeniu, że w momencie kiedy drobiny ligandu otoczą odpowiednie jony metalu bloku , energia orbitali typu określonych jonów metalu ulega zmianie - dochodzi bowiem do rozszczepienia poziomu na dwa inne o różnych wartościach energii (wielkość tego rozszczepienia, a więc różnica energii między wspomnianymi poziomami, zależy m.in. od rodzaju ligandu).
W takim układzie, absorpcja fotonu światła może doprowadzić do wzbudzenia jonu, związanego z przejściem elektronu z poziomu o niższej energii, na poziom o wyższej energii. Absorpcji nie ulegają zwykle wszystkie fotony, ale tylko te, o określonych długościach fali. Pozostała, nie zaabsorbowana część promieniowania daje obserwowaną przez nas barwę, będącą barwą dopełniającą do barwy pochłoniętego promieniowania.
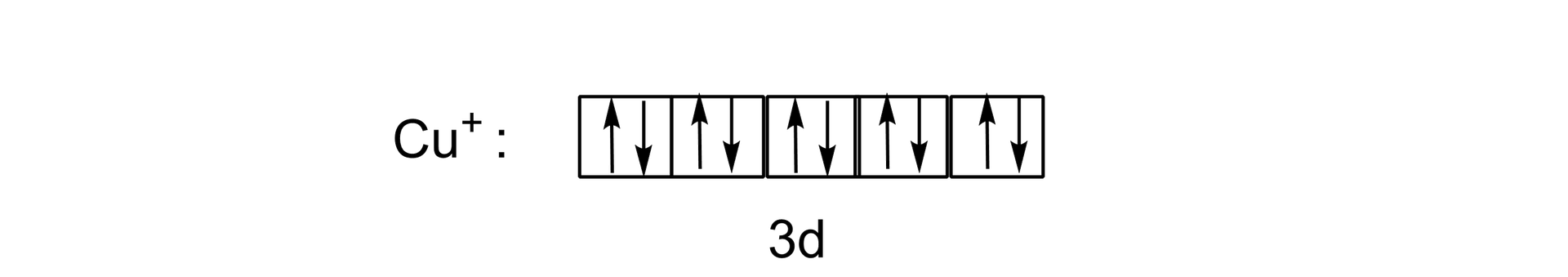
Duża część związków miedzi() jest nietrwała i utlenia się do miedzi() albo dysproporcjonuje według równania reakcji chemicznej:
Znanym kompleksem miedzi() jest stabilny kompleks miedzi(), w którego składzie znajdują się cząsteczki acetonitrylu:
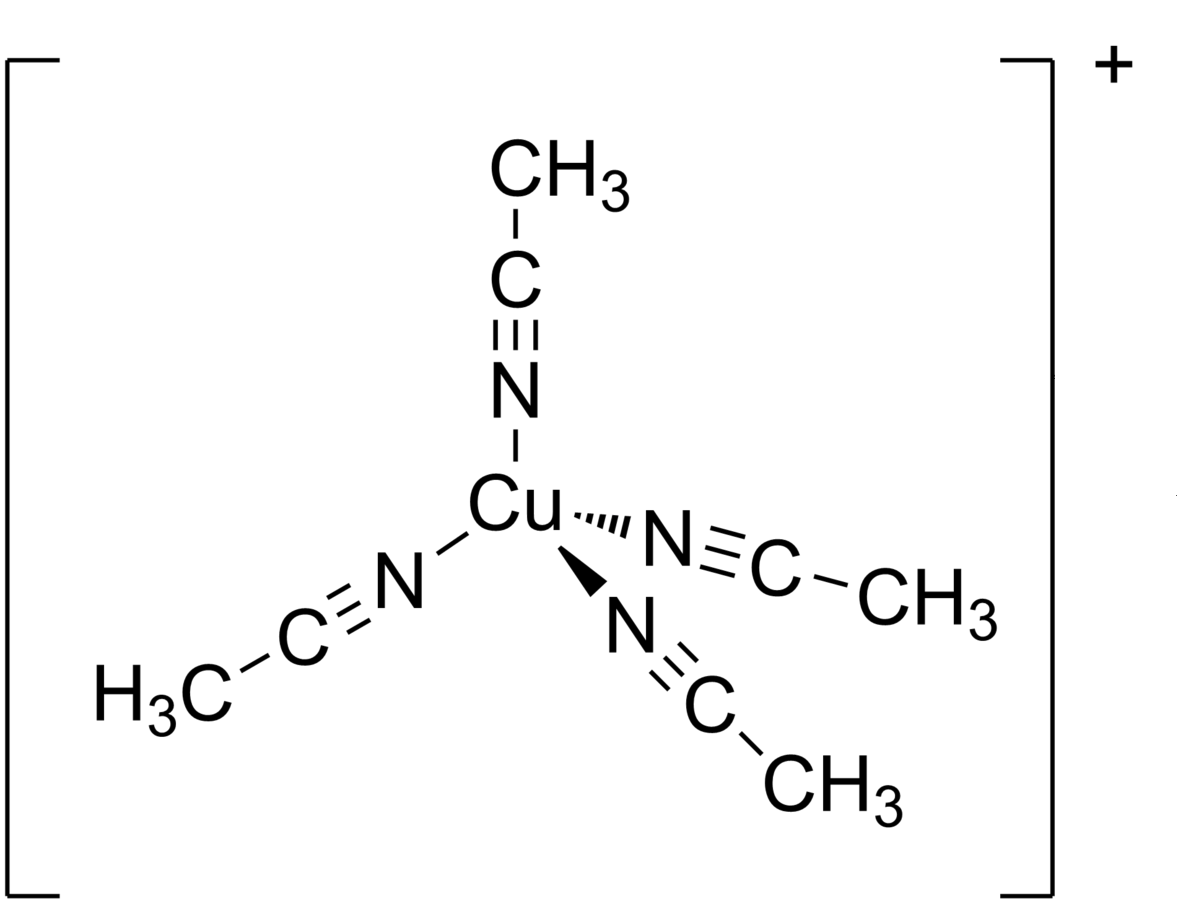
Ten związek chemiczny stanowi wyjściowy substrat w wielu syntezach związków miedzi().
Wyjaśnij w oparciu o strukturę elektronową, dlaczego roztwór tego jonu w acetonitrylu jest bezbarwny.