Wirtualne laboratorium – I
W jaki sposób porównasz właściwości fenolu i alkoholi? Wśród sprzętu laboratoryjnego oraz odczynników chemicznych znajdują się te niezbędne do przeprowadzenia eksperymentu. Zaplanuj eksperyment chemiczny, przeprowadź go, zapisz obserwacje, wyniki i wnioski. Zapisz odpowiednie równania reakcji chemicznych.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1FDNJAcu
Zapoznaj się z opisem doświadczenia, w którym porównano właściwości fenolu i alkoholu.
Analiza eksperymentu: Porównanie fenolu i alkoholi: metanolu i etanolu pod względem ich właściwości chemicznych
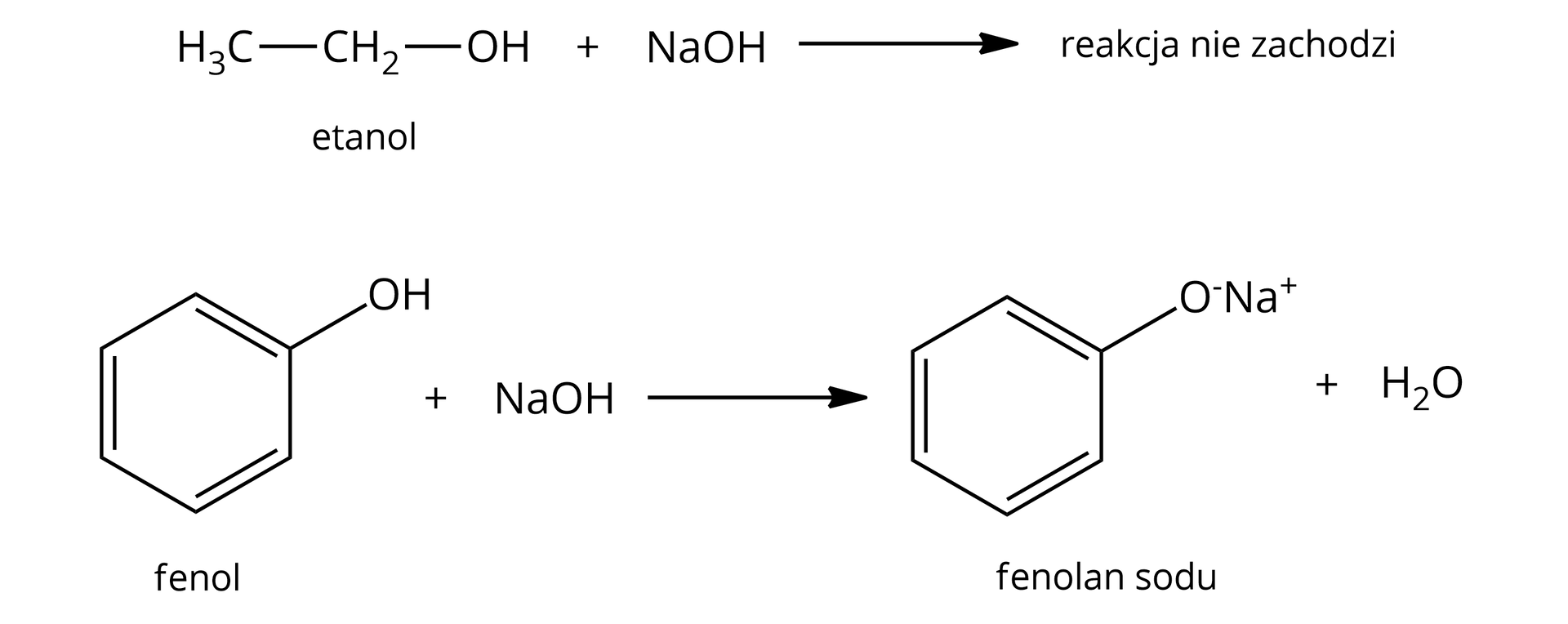
Problem badawczy: Czy badane w doświadczeniu fenol i alkohole reagują z wodnym roztworem wodorotlenku sodu oraz kwasem bromowodorowym?
Hipoteza: Fenol w odróżnieniu od etanolu reaguje z wodnym roztworem wodorotlenku sodu, natomiast metanol w odróżnieniu od fenolu reaguje z kwasem bromowodorowym.
Sprzęt laboratoryjny:
cztery probówki – podłużne naczynia szklane do przeprowadzania prostych reakcji chemicznych;
cztery pręciki szklane służący do mieszania cieczy;
łyżeczka – długi trzonek wykonany ze szkła, porcelany lub metalu zakończony z jednej strony łyżeczką. Służy do nabierania sypkich substancji chemicznych;
pipety Pasteura – wąska rurka do pobierania i przenoszenia niewielkiej ilości cieczy przy pomocy ssawki.
Odczynniki chemiczne:
etanol;
metanol;
fenol;
woda destylowana;
wodny roztwór oranżu metylowego;
alkoholowy roztwór fenoloftaleiny;
roztwór wodorotlenku sodu;
roztwór chlorku żelaza.
Przebieg eksperymentu:
Eksperyment
Aby przygotować odpowiedni roztwór, do jednej z probówek wsypano fenol, a następnie wlano do niego wodę.
Zawartość zamieszano pręcikiem szklanym.
Do drugiej probówki wlano pięć centymetrów sześciennych etanolu.
Do obu probówek dodano jednym centymetrze sześciennym ilość roztworu wodorotlenku sodu. Obie probówki zamieszano szklanym pręcikiem.
Następnie za pomocą szklanych bagietek zawartość wymieszano.
Niewielkie ilości roztworów naniesiono za pomocą bagietek na uniwersalne papierki wskaźnikowe.
Eksperyment
Do jednej z probówek dodano dwa centymetry sześcienne metanolu, a do drugiej fenol.
Do probówki, w której znajdował się fenol, dodano wodę.
Następnie do obu probówek dodano wodny roztwór chlorku żelaza.
Eksperyment
Aby przygotować odpowiedni roztwór, do jednej z probówek wsypano fenol, a następnie dodano pięć centymetrów sześciennych wody.
Zawartość zamieszano pręcikiem szklanym.
Do drugiej probówki wlano dwa centymetry sześcienne metanolua następnie dodano pięć centymetrów sześciennych wody.
Probówkę z fenolem umieszczono w drewnianej łapie, po czym ogrzano w płomieniu palnikai ostudzono.
Niewielkie ilości roztworów naniesiono za pomocą bagietek szklanych na uniwersalne papierki wskaźnikowe.
Obserwacje:
Eksperyment : fenol nie do końća rozpuszcza się w wodzie o temperaturze pokojowej, papierek w przypadku fenololu przybrał jasnozielone zabarwienie, natomiast w przypadku etanolu – ciemnoniebieskie;
Eksperyment : w probówce z metanolem nie zaobserwowano zmian, a w probówce z fenolem po dodaniu żółtego roztworu chlorku żelaza roztwór o fioletowym zabarwieniu, tak zwanym fiołkowym;
Eksperyment : papierek w przypadku fenololu przybrał pomarańczowo‑czerwone zabarwienie, natomiast w przypadku etanolu – żółte.
Wyniki:
Eksperyment : mieszanina wodnego roztworu fenolu i wodorotlenku sodu ma słabo zasadowy charakter, z kolei mieszanina etanolu z wodnym roztworem wodorotlenku sodu wykazuje charakter silnie zasadowy, zatem fenol reaguje z wodnym roztworem wodorotlenku sodu, a pH roztworu otrzymanego w wyniku reakcji fenolu z wodorotlenkiem sodu, w warunkach prowadzenia eksperymentu, wynosi ok. (odczyn zasadowy). Etanol nie reaguje z wodnym roztworem wodorotlenku sodu, a pH otrzymanego roztworu wynosi ok. (równe jest w przybliżeniu pH użytego w doświadczeniu wodnego roztworu wodorotlenku sodu);
Eksperyment : fenol reaguje z chlorkiem żelaza w środowisku wodnym, tworząc dobrze rozpuszczalny w wodzie związek kompleksowy o fioletowym zabarwieniu. Metanol nie reaguje z chlorkiem żelaza.
Eksperyment : po ogrzaniu fenol dobrze rozpuszcza się w wodzie, a odczyn wodnego roztworu fenolu jest kwasowy, natomiast metanol jest dobrze rozpuszczalny w wodzie, a jego wodny roztwór ma obojętny odczyn.
Wnioski:
Hipoteza została potwierdzona – fenol wykazuje inne właściwości chemiczne niż alkohole (metanol i etanol).
W oparciu o wynik doświadczenia ustal, który ze związków chemicznych - metanol czy fenol, wykazuje silniejsze właściwości kwasowe. Odpowiedź krótko uzasadnij.
W oparciu o odpowiednie obliczenia uzasadnij uzyskany wynik eksperymentu, w którym określono zachowanie się fenolu wobec wodnego roztworu wodorotlenku sodu. Załóż, że w czasie trwania eksperymentu użyto wodnego roztworu o stężeniu oraz wodnego roztworu zawierającego stechiometryczną ilość fenolu, a eksperyment prowadzono w temperaturze .