Przeczytaj
Wodne roztwory kwasów mają odczyn kwasowy, a wodne roztwory zasad – zasadowy. A jaki odczyn mają wodne roztwory soli?
Przeanalizuj poniższy schemat hydrolizy wodnych roztworów różnych soli i odpowiedz na powyższe pytanie.
Przeanalizuj opis schematu hydrolizy wodnych roztworów różnych soli i odpowiedz na powyższe pytanie.
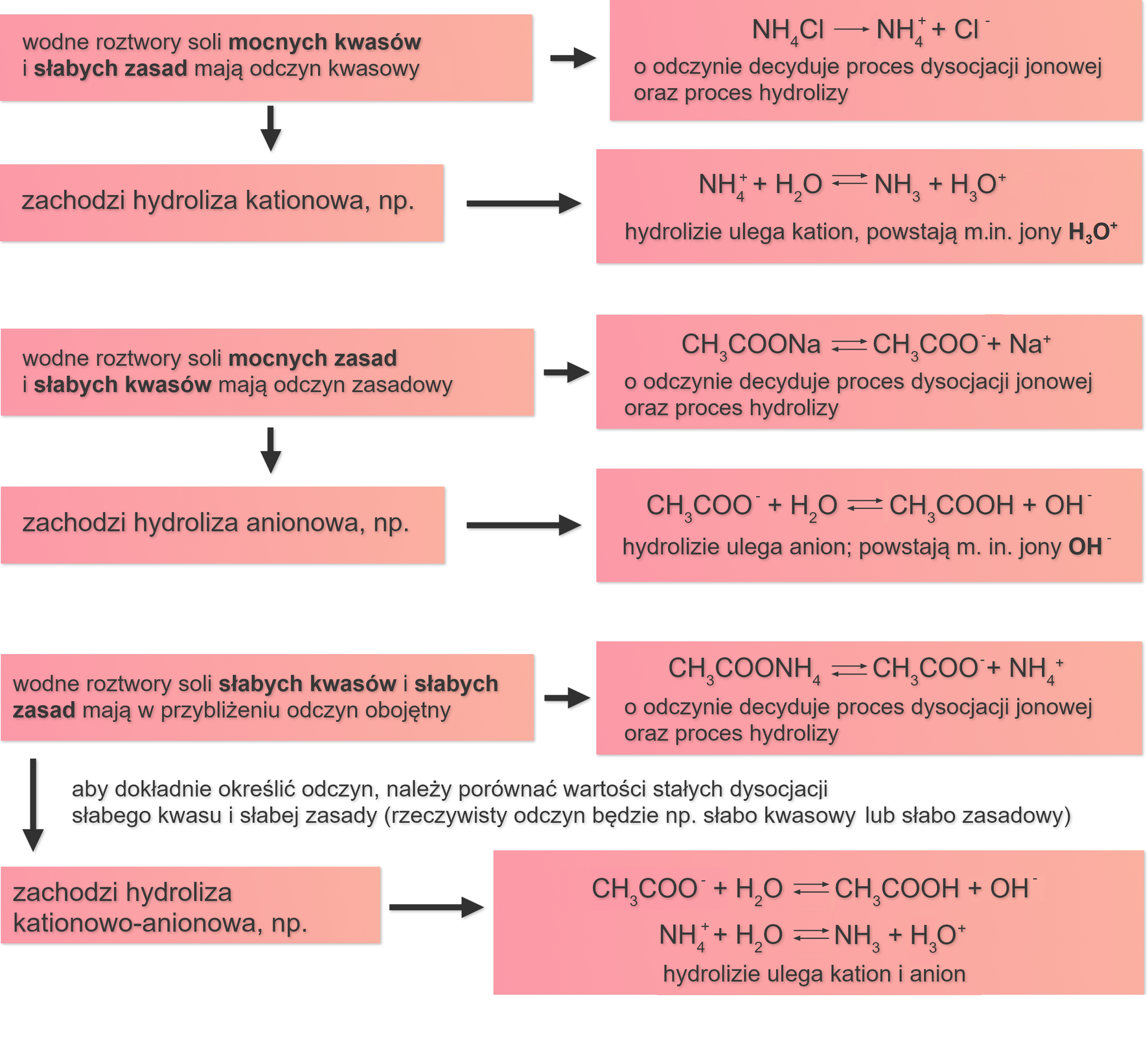
Hydroliza | ||
|---|---|---|
hydroliza kationowa – hydrolizie ulega kation | hydroliza anionowa – hydrolizie ulega anion | hydroliza kationowo‑anionowa – hydrolizie ulega kation i anion |
kwasowy odczyn roztworu | zasadowy odczyn roztworu | odczyn zbliżony do obojętnego |
sole pochodzące od mocnych kwasów i słabych zasad | sole pochodzące od mocnych zasad i słabych kwasów | sole pochodzące od słabych zasad i słabych kwasów |
Tabela 1. Hydroliza – podsumowanie
Indeks górny Źródło: M. Krzeczkowska, J. Loch, A. Mizera, Chemia Repetytorium, Warszawa 2010. Indeks górny koniecŹródło: M. Krzeczkowska, J. Loch, A. Mizera, Chemia Repetytorium, Warszawa 2010.
Aby dokładnie określić odczyn, należy porównać wartości stałych dysocjacjistałych dysocjacji słabego kwasu i słabej zasady, np. w przypadku metanianu (mrówczanu) amonu odczyn jego roztworu wodnego jest bardzo słabo kwasowy (pH < 7), ponieważ:
Słownik
samorzutny proces rozpadu elektrolitów (kwasów, zasad, soli) w roztworach na dodatnio i ujemnie naładowane jony
(gr. hýdōr „woda”, lýsis „rozłożenie”) rozkład substancji pod wpływem wody, reakcja podwójnej wymiany, która zachodzi między wodą a substancją w niej rozpuszczoną oraz prowadzi do powstania cząsteczek nowych związków chemicznych
Przykład reakcji:
cecha roztworu elektrolitu zależna od wzajemnego stosunku stężeń jonów i
stała stosunku iloczynu stężeń jonów powstających podczas dysocjacji elektrolitycznej do stężenia form niezdysocjowanych, pozostających w równowadze chemicznej z jonami; stała w danej temperaturze opisuje dysocjację elektrolitów słabych
Bibliografia
M. Krzeczkowska, J. Loch, A. Mizera, Repetytorium chemia : Liceum - poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.