Przeczytaj
Jak uzasadnić przyczyny odczynu kwasowego i zasadowego wodnych roztworów wybranych substancji?
Aby uzasadnić przyczynę odczynu kwasowego i zasadowego wodnych roztworów wybranych substancji, można posłużyć się teorią kwasów i zasad Brønsteda-Lowry’egoteorią kwasów i zasad Brønsteda-Lowry’ego, która mówi o tym, że:
kwasamikwasami nazywamy związki chemiczne lub jony, które są zdolne do oddania jonów wodoru (protonów) – są to więc donorydonory (dawcy) jonów wodoru (protonów);
zasadamizasadami nazywamy związki chemiczne lub jony, które są zdolne do przyjmowania jonów wodoru (protonów) – są to więc akceptoryakceptory (biorcy) jonów wodoru (protonów).
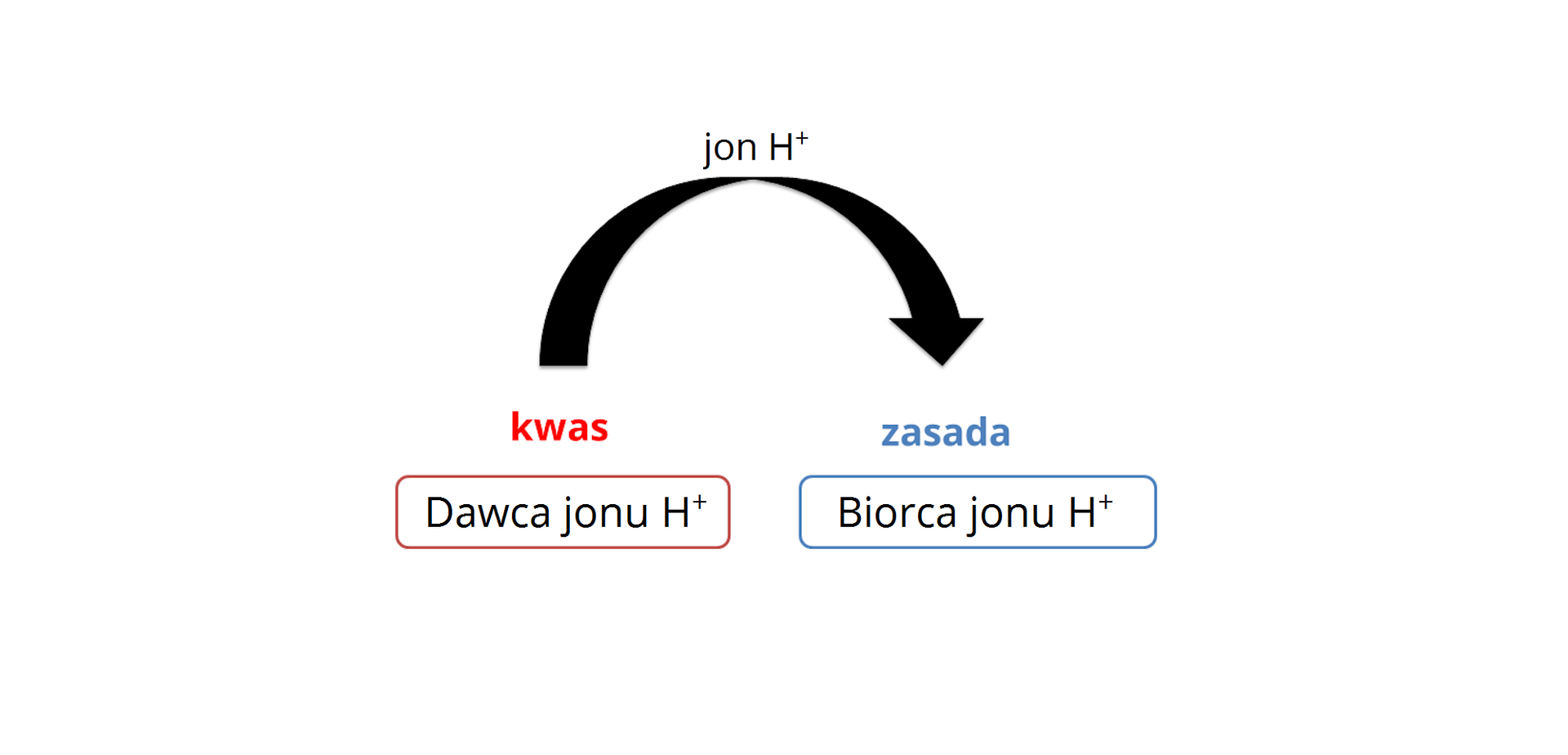
Cząsteczka lub jon kwasu po oddaniu jonu wodoru staje się cząsteczką lub jonem zasady i odwrotnie – cząsteczka lub jon zasady po przyłączeniu jonu wodoru staje się cząsteczką lub jonem kwasu. Można wyróżnić więc tzw. sprzężone pary kwasów i zasad, zgodnie z poniższym schematem:

Należy tutaj zaznaczyć, że im mocniejszy kwas, tym słabsza zasada z nim sprzężona.
Kwasy wg teorii Brønsteda‑Lowry'ego
Dysocjacja elektrolityczna chlorowodoru
Cząsteczka wody pełni rolę zasady, ponieważ pobiera jon wodoru od cząsteczki będącej dawcą tego jonu, czyli pełniącej rolę kwasu.
Dysocjacja elektrolityczna kwasu siarkowego(VI)
Cząsteczka wody pełni rolę zasady w dwuetapowej dysocjacji elektrolitycznej kwasu siarkowego(VI), pobierając jon wodoru najpierw od cząsteczki kwasu siarkowego(VI), a następnie od anionu wodorosiarczanowego(VI) – dawców jonów wodoru.
Zgodnie z teorią Brønsteda-Lowry'ego, funkcję kwasu może pełnić również anion, który pochodzi np. z dysocjacji wodorosoli. Także kation, jak chociażby kation amonu, może pełnić rolę kwasu. Wówczas ulega on reakcji hydrolizy kationowej.
Dysocjacja wodorowęglanu sodu
W roztworze wodnym najpierw zachodzi dysocjacja soli na jony pod wpływem wody:
Następnie anion wodorowęglanowy ulega dalszej dysocjacji pod wpływem wody, oddając jej jon :
W tej reakcji aniony wodorowęglanowe pełnią rolę kwasu, ponieważ oddają jon wodoru do cząsteczki wody, która z kolei pełni rolę zasady.
Należy zwrócić tutaj uwagę, że jon jest jonem amfiprotycznym, czyli takim, który może pełnić rolę zarówno kwasu, jak i zasady wg teorii Brønsteda‑Lowry’ego.
Hydroliza chlorku amonu
W roztworze wodnym najpierw zachodzi dysocjacja soli na jony:
Następnie hydroliza jonów pochodzących od słabego elektrolitu, czyli w tym przypadku kationów amonu. Gdyby oba elektrolity były słabe, to oba uległyby hydrolizie.
W reakcji hydrolizy kationów amonu pełnią one rolę kwasu, gdyż oddają jon wodoru do cząsteczki wody pełniącej rolę zasady.
Zasady wg teorii Brønsteda‑Lowry'ego
Dysocjacja wodorotlenku sodu pod wpływem wody
Podczas rozpuszczania wodorotlenku sodu w wodzie uwalniane są jony i . Należy zwrócić uwagę, że właściwą zasadą Brønsteda-Lowry'ego są jony , a nie jako związek chemiczny. W roztworze wodnym nie istnieją bowiem drobiny .
Zasadowość jonów można udowodnić, zapisując równanie reakcji:
Zgodnie z teorią Brønsteda-Lowry'ego, funkcję zasady mogą również pełnić niektóre aniony pochodzące np. z dysocjacji soli lub wodorosoli.
Hydroliza węglanu sodu
W roztworze wodnym najpierw zachodzi dysocjacja soli na jony:
Następnie zachodzi hydroliza jonów pochodzących od słabego elektrolitu, czyli w tym przypadku anionów węglanowych:
W reakcji hydrolizy anionów węglanowych pełnią one rolę zasady, ponieważ przyjmują jon wodoru od cząsteczki wody, która w tej roli jest kwasem.
Hydroliza wodorosiarczku potasu
W roztworze wodnym najpierw zachodzi dysocjacja soli na jony:
W roztworze wodnym zachodzą jednocześnie dwa procesy: hydrolizy i dysocjacji. Jony będą ulegały dysocjacji zgodnie z równaniem reakcji:
Proces ten zachodzi jednak w niewielkim stopniu. Z dużo większą wydajnością zachodzi proces hydrolizy jonów :
W tym przypadku jony pełnią rolę zasady, bo przyjmują jon wodoru od cząsteczki wody w funkcji kwasu. Dlatego odczyn wodnego roztworu soli jest zasadowy.
Sole o odczynie obojętnym
Niektóre sole wykazują odczyn obojętny lub zbliżony do obojętnego, jeżeli:
pochodzą od mocnego kwasu i mocnej zasady – wówczas reakcja hydrolizy nie zachodzi i odczyn jest obojętny;
pochodzą od słabego kwasu i słabej zasady – wówczas zachodzi hydroliza katinowo‑anionowa i odczyn jest zbliżony do obojętnego.
Hydroliza octanu amonu
W roztworze wodnym najpierw zachodzi dysocjacja soli na jony:
Następnie hydroliza jonów pochodzących od obu elektrolitów – zachodzą procesy hydrolizy zarówno kationów, jak i anionów:
Odczyn roztworów takich soli jest zbliżony do obojętnego. Większość powstających jonów i ulega wzajemnemu zobojętnieniu. W przypadku, gdy któryś z procesów hydrolizy zachodzi znacznie wydajniej, to odczyn roztworu może być bardzo słabo kwasowy lub bardzo słabo zasadowy. Niemniej na poziomie szkolnym przyjmujemy po prostu, że odczyn ten jest zbliżony do obojętnego.
To, który proces zachodzi wydajniej zależy od stały równowagi (stałych hydrolizy) poszczególnych jonów.
Słownik
roztwór w którym stężenie jonów jest większe od stężenia jonów – oznacza to, że w temperaturze 25°C pH jest większe od 7
roztwór w którym stężenie jonów jest równe stężeniu jonów – oznacza to, że w temperaturze 25°C pH jest równe 7
roztwór w którym stężenie jonów jest mniejsze od stężenia jonów – oznacza to, że w temperaturze 25°C pH jest mniejsze od 7
teoria, wg której kwasami są cząstki (cząsteczki, jony) będące donorami protonów (oddają jony wodoru) w reakcji z akceptorami protonów (cząstkami przyjmującymi jony wodoru), będące z kolei zasadami
każda substancja, która może odłączyć od siebie jon wodoru
każda substancja, która może przyłączyć do siebie jon wodoru
dawca jonu wodoru
biorca jonu wodorowego
to para reagentów, w której kwasem jest cząsteczka lub jon stanowiące donor jonu wodorowego, a zasadą cząsteczka lub jon powstałe w wyniku odszczepienia tego jonu wg równania:

dysocjacja elektrolityczna rozpuszczalnika amfiprotycznego, zachodząca wskutek wymiany jonów wodorowych między jego cząsteczkami
substancja, indywiduum chemiczne (cząsteczka, jon), które wg teorii kwasów i zasad Brønsteda-Lowry’ego może – zależnie od środowiska reakcji – przyłączać lub odłączać jeden lub więcej jonów wodorowych