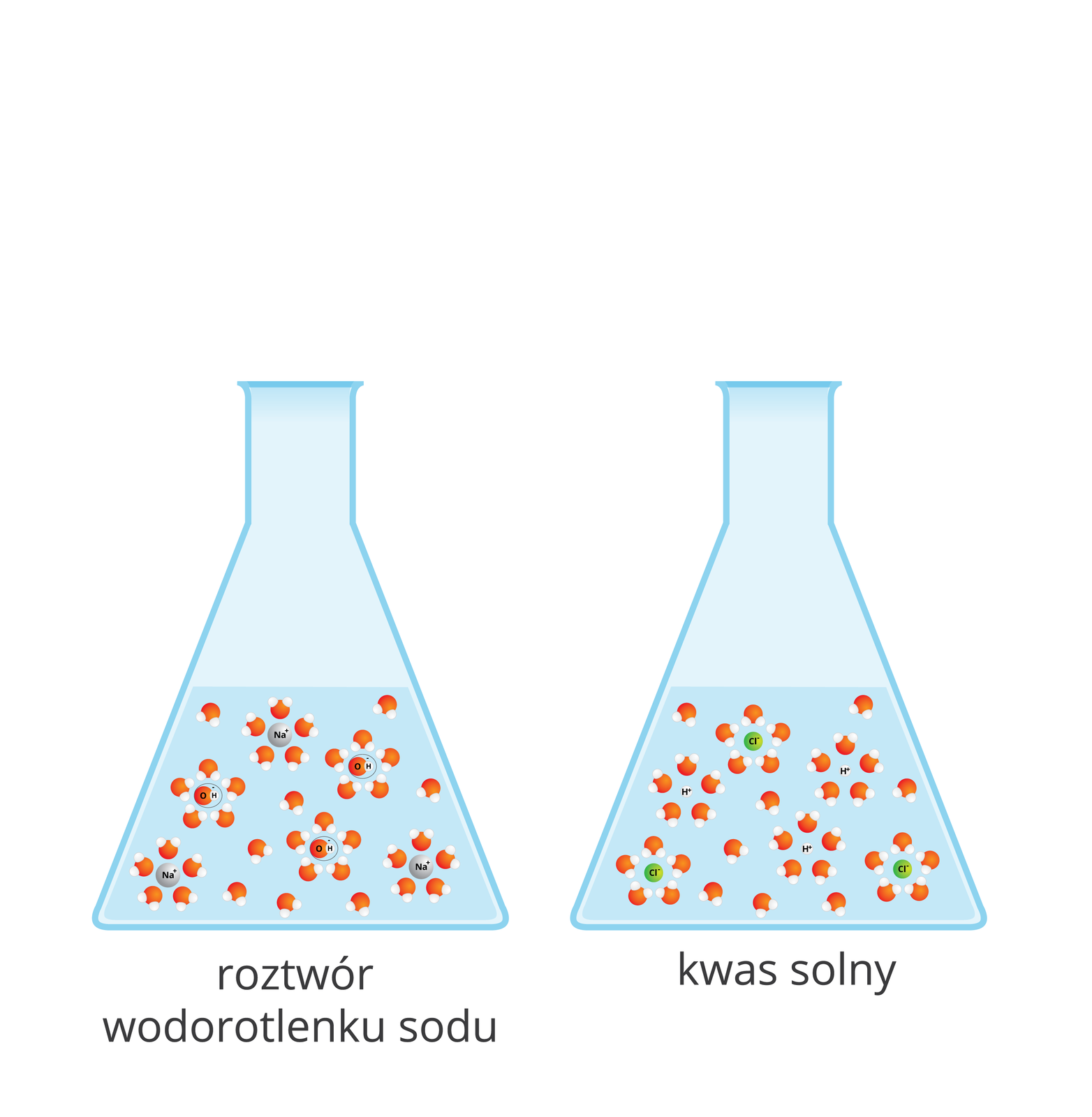
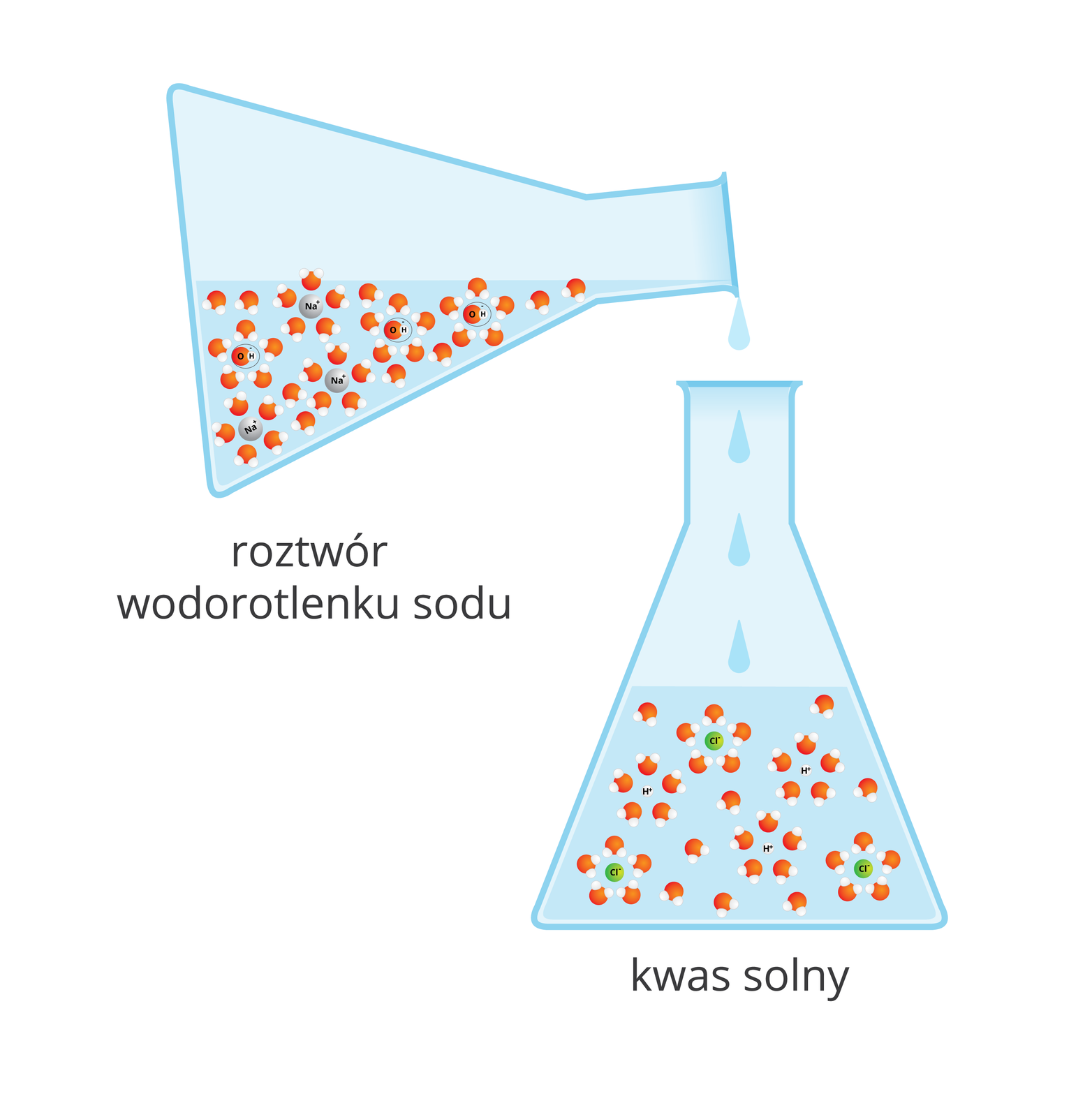
Reakcja zobojętniania
Czy można w jakiś sposób sprawić, aby roztwór stał się mniej kwasowy, a ten o odczynie zasadowym zyskał niższe pH?
że istnieją wodorotlenki rozpuszczalne w wodzie (np. , ) oraz słabo i trudno rozpuszczalne w wodzie (np. );
że zasady dysocjują w wodzie na kationy metalu i aniony wodorotlenkowe;
że roztwory wodorotlenków mają odczyn zasadowy,
że kwasy dysocjują w wodzie na kationy wodoru i aniony reszty kwasowej;
że odczyn roztworów kwasów jest kwasowy.
przedstawiać w formie cząsteczkowej i jonowej (pełnej i skróconej) równanie reakcji między kwasem chlorowodorowym a wodorotlenkiem sodu, zachodzącej w roztworze wodnym;
wyjaśniać, na czym polega reakcja zobojętniania;
wskazywać substancje, które ulegają reakcji zobojętniania.
1. Czy wodorotlenki mogą reagować z kwasami?
Czy wodorotlenek sodu reaguje w roztworze wodnym z kwasem solnym?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Wodorotlenek sodu reaguje w roztworze wodnym z kwasem solnym.
Wodorotlenek sodu nie reaguje w roztworze wodnym z kwasem solnym.
kolba stożkowa,
pipety,
rozcieńczony roztwór wodorotlenku sodu,
rozcieńczony kwas solny,
bagietka,
wskaźnik kwasowo‑zasadowy: fenoloftaleina.
Do kolby stożkowej wlej kilkadziesiąt cmIndeks górny 33 roztworu wodorotlenku sodu.
Dodaj kilka kropli roztworu fenoloftaleiny.
Do roztworu wodorotlenku dodawaj kroplami, za pomocą pipety, kwas solny. Stale mieszaj zawartość kolby stożkowej.
Obserwuj zachodzące zmiany. Zakończ doświadczenie, gdy dostrzeżesz zmiany. Nie dodawaj zbyt dużo kropli kwasu solnego.
Przenieś roztwór do parownicy.
Ogrzewaj delikatnie parownicę i odparuj jej zawartość do sucha.
Porównaj pozostałość w parownicy ze stałym wodorotlenkiem sodu.
Dodaj wodę do osadu, a następnie zbadaj odczyn powstałego roztworu za pomocą fenoloftaleiny.
Fenoloftaleina w roztworze wodorotlenku sodu zabarwiła się na kolor malinowy. Podczas dodawania kwasu solnego po pewnym czasie nastąpiło odbarwienie roztworu. Po odparowaniu wody z roztworu powstała biała substancja stała, która wyglądem nie przypominała substancji użytych do reakcji. Fenoloftaleina nie zabarwiła się w roztworze tej substancji.
Wodorotlenek sodu przereagował z kwasem solnym. W wyniku tej reakcji powstała nowa substancja – chlorek sodu. Przemianę tę opisuje poniższe równanie:
Film dostępny na portalu epodreczniki.pl
Nagranie rozpoczyna ujęcie stołu laboratoryjnego z rozmieszczonymi na blacie elementami niezbędnymi do przeprowadzenia eksperymentu. Niektóre z elementów są podpisane: kolba stożkowa z roztworem wodorotlenku sodu, mała zlewka z kwasem solnym, oraz nieco mniejsza zlewka z fenoloftaleiną. Ponadto znajdują się tam naczynie Petriego z papierkami wskaźnikowymi oraz dwie proste pipety. Zmiana ujęcia, eksperymentator nabiera pipetą nieco fenoloftaleiny i dodaje ją do kolby z wodorotlenkiem sodu, który to roztwór natychmiast przybiera barwę malinową. Na ekranie obok kolby pojawia się podpis Odczyn zasadowy. Zmiana ujęcia, stół pokazany z szerszej perspektywy, tak że widoczna jest cała kolba i stojąca obok zlewka z kwasem. Eksperymentator nabiera drugą pipetą kwas solny i dodaje go małymi porcjami do kolby z zabarwionym roztworem zasady sodowej. Następnie miesza zawartość kolby i dodaje ponownie. Zmiana ujęcia, podczas któregoś z kolei mieszania roztwór staje się bezbarwny. Na ekranie obok kolby pojawia się podpis Brak odczynu zasadowego. Zmiana ujęcia, eksperymentator przelewa zawartość kolby do porcelanowej parowniczki stojącej na siatce grzewczej ustawionej nad palnikiem gazowym. Zmiana ujęcia, pokazane zostaje wnętrze parowniczki po odparowaniu wody. Na dnie znajdują się bardzo drobne białe kryształki. Eksperymentator nalewa do parowniczki wodę i miesza zawartość bagietką. Osad znika, rozpuszczając się. Następnie za pomocą bagietki przenosi kilka kropel roztworu na papierek wskaźnikowy na leżącej obok parowniczki szalce Petriego. Papierek bardzo delikatnie zmienia kolor z żółtego na żółtozielony, co oznacza odczyn obojętny. Na tle sceny pojawia się w górnej części ekranu zapis reakcji NaOH plus HCl daje w efekcie NaCl plus H2O. Wzorom związków towarzyszą nazwy zapisane słownie.
Wodorotlenek sodu reaguje nie tylko z kwasem solnym, ale także i z innymi kwasami, np. siarkowym(VI), siarkowym(IV), azotowym(V) czy fosforowym(V). W podobny sposób zachowują się wszystkie rozpuszczalne w wodzie wodorotlenki.
Czy wodorotlenki słabo rozpuszczalne w wodzie reagują z kwasami?
Czy słabo rozpuszczalne wodorotlenki reagują z kwasami?
Wybierz jedną z przedstawionych hipotez, a następnie zweryfikuj ją.
Słabo rozpuszczalne wodorotlenki reagują z kwasami.
Słabo rozpuszczalne wodorotlenki nie reagują z kwasami.
probówki,
pipety,
bagietki,
przygotowane przez nauczyciela tuż przed wykonaniem doświadczenia wodorotlenki: miedzi(II), żelaza(III), magnezu(II), glinu (otrzymane np. w wyniku reakcji chlorków: miedzi(II), żelaza(III), magnezu, glinu z wodorotlenkiem sodu lub potasu),
rozcieńczone roztwory kwasów: solnego, siarkowego(VI), azotowego(V).
Zawiesinę (1–2 cmIndeks górny 33) każdego z badanych wodorotlenków umieść w 4 probówkach.
Do każdej z probówek dodaj inny kwas: do pierwszej – solny, do drugiej – siarkowy(VI), do trzeciej – azotowy(V).
Do czwartej probówki wlej podobną objętość wody (próbka kontrolna).
Obserwuj, co dzieje się z wodorotlenkami po dodaniu każdej z cieczy.
W miarę dodawania kwasów: solnego, siarkowego(VI), azotowego(V) do zawiesin wodorotlenków: miedzi(II), żelaza(III), magnezu, glinu następowało zanikanie osadów wodorotlenków. Powstałe roztwory były klarowne, natomiast zawartość probówki z wodorotlenkiem miedzi(II) miała barwę niebieską, zaś probówka z wodorotlenkiem żelaza(III) – żółtą. Po wlaniu wody do probówek osady wodorotlenków pozostały niezmienione.
Wszystkie wodorotlenki przereagowały z kwasami. W próbie kontrolnej nie reagowały z wodą i się w niej nie rozpuściły.
Wodorotlenki słabo rozpuszczalne w wodzie także reagują z kwasami, takimi jak na przykład: siarkowy(VI), solny, azotowy(V).
2. Jak przebiega reakcja zobojętniania?
Przebieg reakcji pomiędzy wodorotlenkiem sodu i kwasem chlorowodorowym można przedstawić w postaci równania:
Wiemy, że w roztworze wodnym rozpuszczalne w wodzie wodorotlenki i kwasy ulegają procesowi dysocjacji:
Z tego względu w reakcji między tymi substancjami biorą udział jony. Zapiszmy więc równanie reakcji z ich użyciem:
Taki zapis przebiegu reakcji nazywa się zapisem jonowym pełnymzapisem jonowym pełnym.

Zauważmy, że podczas reakcji wodorotlenku sodu z kwasem solnym reagują tylko dwa jony: kation wodoru i anion wodorotlenkowy, które razem tworzą cząsteczkę wody. Pomińmy w równaniu reakcji jony niebiorące udziału w reakcji:

i zapiszmy równanie, które opisuje właściwe procesy zachodzące podczas reakcji chemicznej:
Ten sposób przedstawienia przebiegu reakcji chemicznej – z użyciem wyłącznie jonów biorących udział w reakcji – nazywa się zapisem jonowym skróconymzapisem jonowym skróconym.
Jak pamiętamy, aniony wodorotlenkowe odpowiadają za odczyn zasadowy, natomiast kationy wodoru – za odczyn kwasowy. Odczyn roztworu, który powstał po reakcji wodorotlenku sodu z kwasem solnym, był obojętny. Dlatego właśnie reakcję między kwasem a wodorotlenkiem nazwano reakcją zobojętnianiareakcją zobojętniania. Czasami określa się ją mianem reakcji neutralizacji. Jej istota polega na łączeniu się kationów wodoru z anionami wodorotlenkowymi i tworzeniu się cząsteczek wody.
3. Przykłady reakcji między wodorotlenkami a kwasami


Zapisz równanie reakcji wodorotlenku wapnia z kwasem solnym.
Substrat 1 | Substrat 2 | Kierunek reakcji | Produkt 1 | Produkt 2 |
wodorotlenek potasu | kwas solny | |||
wodorotlenek potasu | kwas siarkowy(VI) | |||
wodorotlenek sodu | kwas siarkowy(IV) | |||
wodorotlenek miedzi(II) | kwas siarkowy(VI) | |||
wodorotlenek miedzi(II) | kwas azotowy(V) | |||
wodorotlenek magnezu | kwas siarkowy(VI) | |||
wodorotlenek magnezu | kwas azotowy(V) | |||
wodorotlenek żelaza(III) | kwas siarkowy(VI) | |||
wodorotlenek żelaza(III) | kwas solny | |||
wodorotlenek żelaza(III) | kwas azotowy(V) |
Film dostępny na portalu epodreczniki.pl
Na ekranie widać treść zadania, która będzie widoczna przez cały czas i na każdym ekranie: Zapisz równanie reakcji wodorotlenku wapnia z kwasem solnym. Pod spodem pojawia się początek równania: wodorotlenek wapnia + kwas solny ->. Uzupełnia się równanie: wodorotlenek wapnia + kwas solny -> woda + chlorek wapnia. Pod równaniem opisanym słownie pojawia się drugie: Ca(OH)2 + HCl -> CaCl2+ H2O. Pod równaniem pojawia się tabela. Wyróżnia się drugi wiersz z Ca w tabeli. Równanie uzupełnia się. Liczby w tabeli zmieniają się. Równanie uzupełnia się. Dane w tabeli się poprawiają. Równanie reakcji zostaje wyróżnione.
4. Wykorzystanie reakcji zobojętniania

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/a/D1GFj8cYa
Podsumowanie
W roztworze wodnym wodorotlenki reagują z kwasami.
W wyniku reakcji wodorotlenku sodu z kwasem solnym powstaje chlorek sodu.
Przemiana polegająca na reakcji anionów wodorotlenkowych z kationami wodoru, w wyniku której powstają obojętne cząsteczki wody, nazywa się reakcją zobojętniania.
Wyjaśnij, dlaczego w składzie leków zobojętniających kwas solny w żołądku nie ma wodorotlenku sodu. Podpowiedzi szukaj na przykład w karcie charakterystyki tej substancji.
Słowniczek
zapis przedstawiający przebieg reakcji w roztworze wodnym; przedstawia rozpuszczalne w wodzie substraty i produkty jako jony (zgodnie z ich dysocjacją)
reakcja między kwasem a wodorotlenkiem, która polega na reakcji kationów wodoru z anionami wodorotlenkowymi z utworzeniem cząsteczek wody
równanie reakcji przebiegającej w roztworze wodnym; przedstawia substancje i jony faktycznie biorące udział w reakcji
Zadania
Uzupełnij luki w tekście. Wybierz właściwe określenia spośród podanych.
anionami wodorotlenkowymi, sodu i wody, anionami fosforanowymi(V), kationami sodu, woda, zobojętniania, chlorowodór, nie reaguje, reaguje, spalania, kwasu siarkowego(VI) z wodorotlenkiem sodu, kwasu solnego z wodorotlenkiem sodu, kationami wodoru, utleniania, wodoru i chloru, cząsteczkami wody, wodorotlenek sodu, anionami siarczanowymi(VI), sodu i chloru, anionami chlorkowymi, cząsteczkami wody, tlenek sodu
Kwas solny ...................................................................................... z wodorotlenkiem sodu. Chlorek sodu i ...................................................................................... są produktami reakcji ....................................................................................... Reakcje wodorotlenków z kwasami są przykładem reakcji ....................................................................................... Reakcja ta zachodzi między ...................................................................................... i .......................................................................................
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Wodorotlenek sodu reaguje z kwasem siarkowym(VI). | □ | □ |
| W reakcji zobojętniania powstają dwa produkty. | □ | □ |
| Wodorotlenek żelaza(III) nie reaguje z kwasem solnym. | □ | □ |
| Jednym z produktów reakcji wodorotlenku potasu z kwasem solnym jest woda. | □ | □ |
Wybierz substancje, które reagują z kwasem solnym.
wodorotlenek potasu, wodorotlenek magnezu, wodorotlenek miedzi(II), wodorotlenek sodu, wodorotlenek glinu, wodorotlenek żelaza(III)
| reakcja zobojętniania z kwasem solnym |
|---|
Wskaż równanie reakcji zobojętniania kwasu solnego z wodorotlenkiem sodu.
Wskaż równanie reakcji zobojętniania zachodzącej między wodorotlenkiem potasu a kwasem solnym.
Wskaż równanie, które przedstawia istotę reakcji zobojętniania.
Dobierz współczynniki stechiometryczne reakcji wodorotlenku baru z kwasem siarkowym(VI), a następnie wskaż ich prawidłowy ciąg:
- 1, 1, 1, 2
- 2, 1, 2, 2
- 1, 1, 1, 1
- 1, 1, 1, 3
- 2, 1, 2, 1
Wskaż nazwę typu reakcji, do którego zalicza się reakcja zobojętniania.
- Reakcja wymiany.
- Reakcja syntezy.
- Reakcja analizy.
Jak zmienia się odczyn roztworu, który powstaje w wyniku dodawania kwasu solnego do roztworu wodorotlenku sodu? Wskaż prawidłową odpowiedź.
- pH roztworu maleje
- pH roztworu rośnie
- pH roztworu nie zmienia się