Kwasy karboksylowe – właściwości
W przyrodzie występują kwasy karboksylowe. Można je znaleźć w kwiatach winorośli, jabłkach, a nawet w ziarnach kawy i kakao. Nazwy zwyczajowe kwasów karboksylowych są związane z miejscem występowania. Na przykład „ocet” to potoczna nazwa roztworu kwasu octowego. Kwas szczawiowy znajduje się w liściach szczawiu i rabarbarze, zaś mrówki wydzielają kwas mrówkowy. Słowo „kwas” wskazuje na wspólne właściwości.
jak zbudowane są cząsteczki kwasów karboksylowych;
jak narysować wzory strukturalne kwasów karboksylowych;
jak tworzymy nazwy kwasów.
zapisywać równania reakcji dysocjacji kwasów karboksylowych;
zapisywać równania reakcji otrzymywania soli kwasów karboksylowych.
1. Właściwości fizyczne kwasu octowego
OcetOcet jest stosowany w kuchni jako przyprawa lub środek konserwujący żywność. Z pewnością znacie jego kwaśny smak. Z etykiety możemy się dowiedzieć, iż ocet jest 10‑procentowym wodnym roztworem kwasu octowego. Bezwodny kwas octowy w temperaturze poniżej 16°C przybiera postać bezbarwnej masy. Wyglądem przypomina ona lód – stąd nazwa kwas lodowaty. Kwas octowy jako produkt skwaśniałego wina towarzyszy człowiekowi od najdawniejszych czasów.

W zależności od surowca poddanego fermentacji rozróżnia się ocet spirytusowyocet spirytusowy, winny, owocowy, słodowy, piwny, melasowy czy ryżowy. Ocet, używany do przygotowania marynat i majonezów, nadaje im charakterystyczny smak i aromat. Spożywany w niewielkich ilościach, wzmaga apetyt i poprawia trawienie. Jest również używany w gospodarstwie domowym jako środek dezynfekujący i czyszczący.
Jakie właściwości fizyczne ma kwas octowy?
Kwas ocetowy jest cieczą rozpuszczalną w wodzie.
kwas octowy,
probówka,
woda.
Do probówki wlej ok. 3 cmIndeks górny 33 kwasu octowego.
Określ stan skupienia i barwę kwasu octowego.
Do probówki ostrożnie dolej ok. 3 cmIndeks górny 33 wody.
Zaznacz poziom cieczy w probówce.
Wstrząśnij zawartością.
Sprawdź, czy kwas octowy rozpuszcza się w wodzie.
Zaobserwuj, czy poziom cieczy po zmieszaniu zmniejszył się.
R1HY31WINlIw51 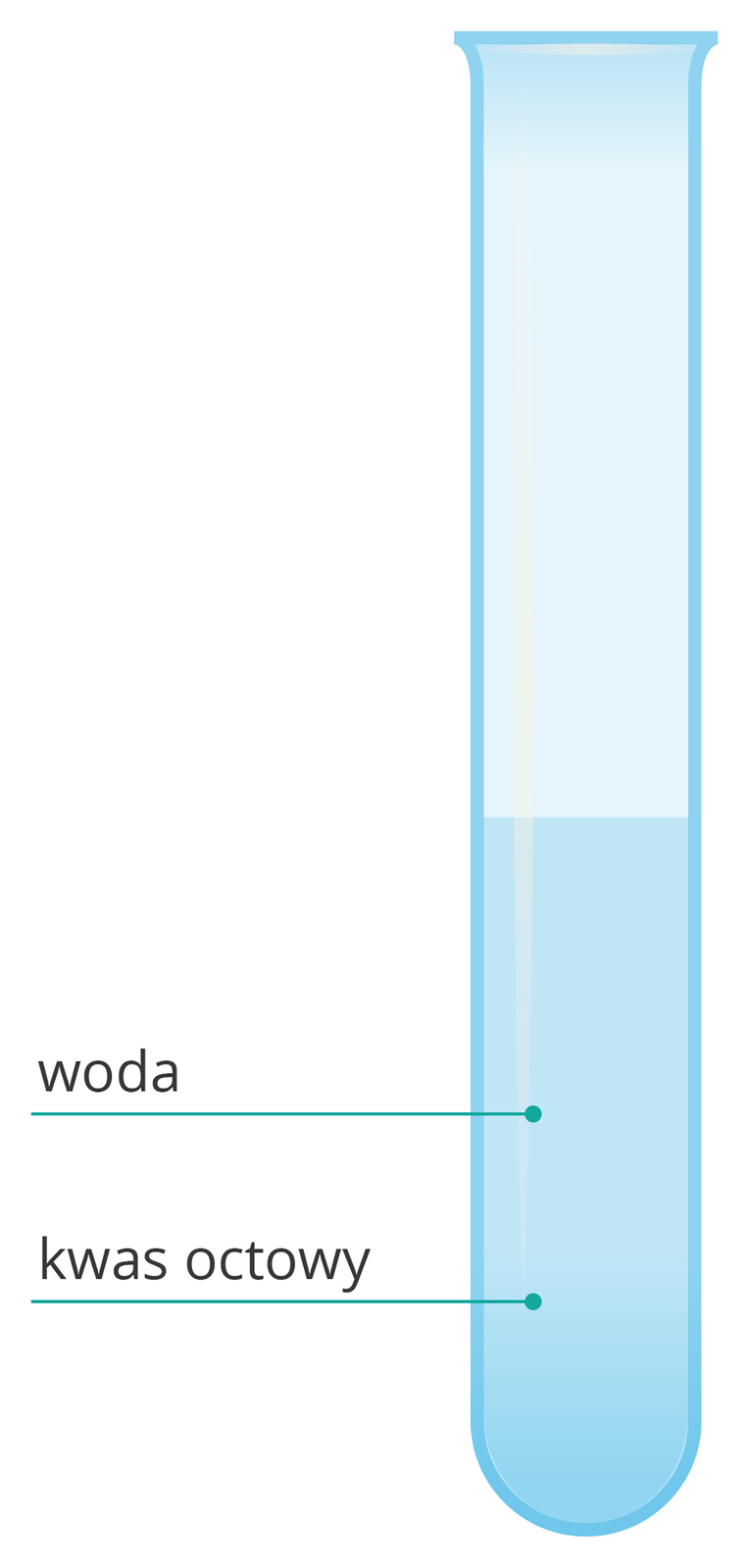 Źródło: Dariusz Adryan, licencja: CC BY 3.0.
Źródło: Dariusz Adryan, licencja: CC BY 3.0.
Kwas octowy jest bezbarwną cieczą, dobrze rozpuszcza się w wodzie. Jego rozpuszczaniu towarzyszy zjawisko kontrakcji objętości. Polega ono na zmianie objętości mieszaniny wskutek oddziaływań międzycząsteczkowych składników mieszaniny.
2. Właściwości chemiczne kwasu octowego
Badając kwas octowy, odpowiemy na pytania: Jakie właściwości chemiczne mają niższe kwasy karboksylowe? Czy reagują z metalami i ich tlenkami podobnie jak kwasy nieorganiczne? Jaki wpływ na ich odczyn ma obecność grupy karboksylowej? Czy wskaźniki w wodnych roztworach kwasów organicznych zmieniają zabarwienie tak samo jak w wodnych roztworach kwasów nieorganicznych?
Jakie właściwości kwasu octowego możemy odczytać z piktogramów?

Z piktogramów dowiadujemy się, że stężony kwas octowy jest substancją łatwopalną. Powoduje oparzenia skóry oraz oczu. Ze względu na zagrożenia w szkolnej pracowni chemicznej nie przechowuje się stężonego roztworu kwasu octowego. Do doświadczeń używamy jedynie roztwór kwasu octowego, którego stężenie nie przekracza 10%.
Zapach kwasu octowego
Kwas octowy można bardzo łatwo rozpoznać po ostrym, charakterystycznym zapachu. Z tego względu butelkę z kwasem staramy się szybko i szczelnie zamykać.
Dysocjacja elektrolityczna kwasów karboksylowych
Jak sprawdzić, czy wodne roztwory kwasów ulegają dysocjacji jonowej?
Jeżeli w roztworze wodnym kwasów organicznych są obecne jony, to zauważymy przewodnictwo elektryczne.
ocet,
zlewka o poj. 50 cmIndeks górny 33,
aparat do pomiaru przewodnictwa elektrycznego.
Zlewkę napełnij octem do ok. 1/5 objętości.
Zanurz w zlewce elektrody aparatu do pomiaru przewodnictwa.
Zwróć uwagę, czy żarówka się zaświeciła.
RayV63tOVrtxw1 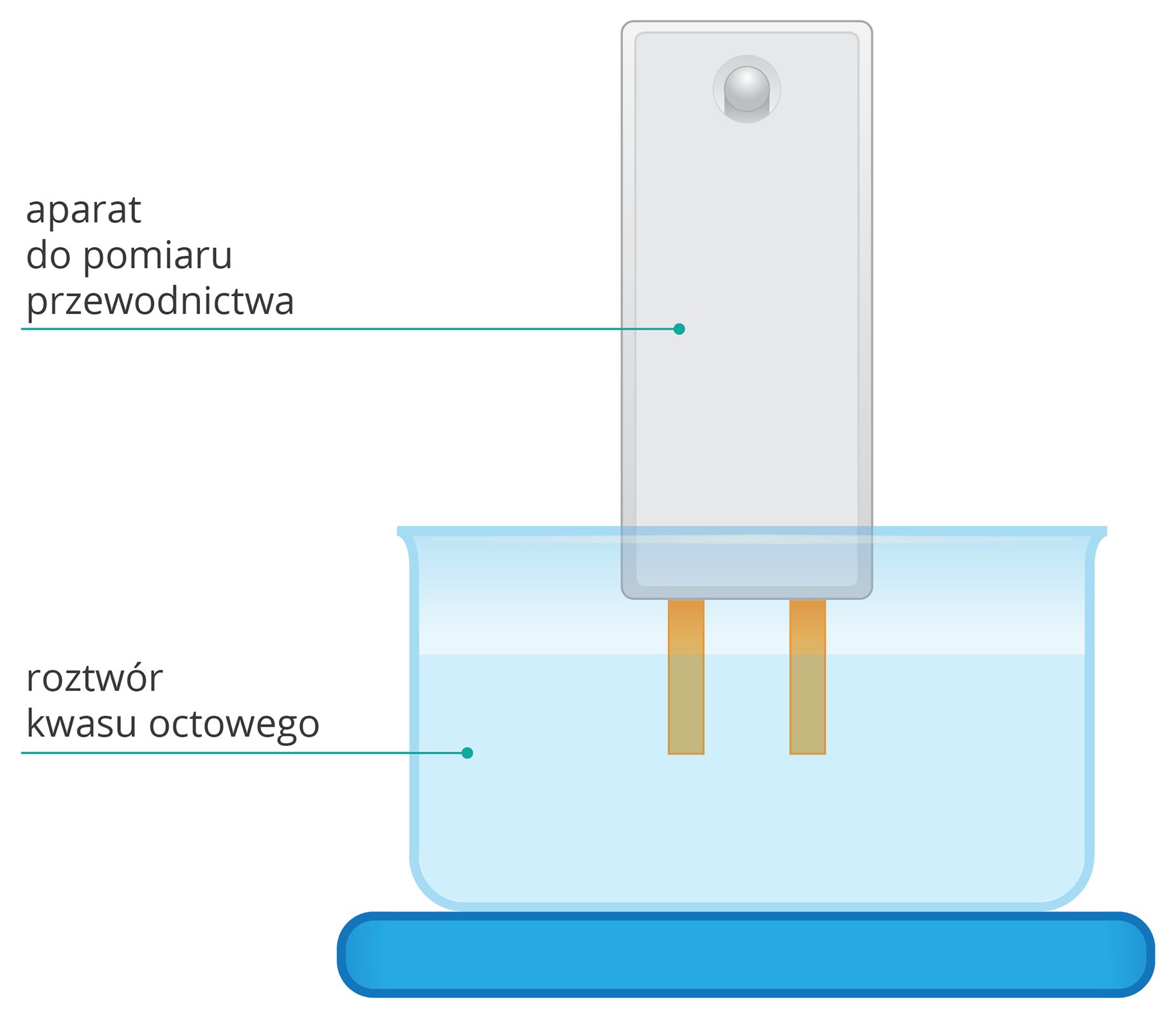 Badanie przewodnictwa roztworu kwasu octowego
Badanie przewodnictwa roztworu kwasu octowegoR1IA013N2XnNp1  Źródło: Tomorrow Sp.z o.o., licencja: CC BY 3.0.
Źródło: Tomorrow Sp.z o.o., licencja: CC BY 3.0.
Żarówka aparatu do pomiaru przewodnictwa elektrycznego zaświeciła się. Przewodnictwo prądu elektrycznego potwierdziło obecność jonów w roztworze. Kwas octowy ulega dysocjacji elektrolitycznej.
Zapis równania dysocjacji jonowej kwasu octowego:
Kation wodoru pochodzi z grupy karboksylowej.
Odczyn kwasów karboksylowych
Jaki odczyn ma wodny roztwór kwasu octowego?
Odczyn wodnego roztworu kwasu octowego jest taki sam jak odczyn wodnych roztworów kwasów nieorganicznych.
Barwy wskaźników w roztworze wodnego kwasu octowego nie ulegają zmianie.
ocet,
wywar z czerwonej kapusty,
uniwersalny papierek wskaźnikowy,
dwie probówki,
bagietka.
Do dwóch probówek wlej po ok. 3 cmIndeks górny 33 octu.
Do jednej probówki wlej kilka kropli wywaru z czerwonej kapusty,
Z drugiej probówki pobierz bagietką kilka kropli i nanieś na wilgotny papierek uniwersalny.
Co zaobserwowałeś?
R1IBmiEGV66ql1  Badanie odczyny kwasu octowego
Badanie odczyny kwasu octowegoR1UTsbyFn0ifL1  Badanie odczynu kwasu octowego
Badanie odczynu kwasu octowego
Uniwersalny papierek wskaźnikowy i wywar z czerwonej kapusty zabarwiły się na kolor czerwony. Wodny roztwór kwasu octowego ma odczyn kwasowy. A zatem w roztworze kwasu znajdują się kationy wodoru.
Reakcja kwasu octowego z zasadą
Czy kwas octowy reaguje z zasadami?
Kwasy nieorganiczne można zobojętnić zasadami. Podobnej reakcji powinien ulec kwas octowy.
wodny roztwór kwasu octowego,
wodny roztwór wodorotlenku sodu (zasada sodowa),
roztwór fenoloftaleiny,
probówka.
Wlej do probówki ok. 3 cmIndeks górny 33 roztworu wodorotlenku sodu.
Dodaj 2–3 krople fenoloftaleiny.
Dodawaj kroplami wodny roztwór kwasu octowego.
Obserwuj zmiany barwy zawartości probówki.
RnR2f11cbXq0l1  Reakcja kwasu octowego z zasadą sodową
Reakcja kwasu octowego z zasadą sodową
Fenoloftaleina w obecności zasady sodowej zabarwiła się na malinowo. W trakcie dodawania roztworu kwasu octowego następowało stopniowe odbarwienie roztworu. Fakt ten dowodzi, że w probówce zaszła reakcja zobojętniania. Kwas octowy zobojętnił zasadę sodową. Produktami reakcji były: octan sodu (etanian sodu) i woda.
Reakcja kwasu octowego z metalami
Czy kwas octowy reaguje z metalami?
Kwas octowy reaguje z magnezem tak samo jak kwasy nieorganiczne.
Wodór wydziela się podczas reakcji kwasu octowego z magnezem.
wodny roztwór kwasu octowego,
wiórki magnezowe,
probówka.
Wlej do probówki ok. 3 cmIndeks górny 33 wodnego roztworu kwasu octowego.
Wrzuć do probówki niewielką ilość wiórków magnezowych.
Obserwuj zachodzące zmiany.
Zbliż palące łuczywo do wylotu probówki.
Zwróć uwagę na efekty dźwiękowe reakcji.
R1VFanavcxBJR1 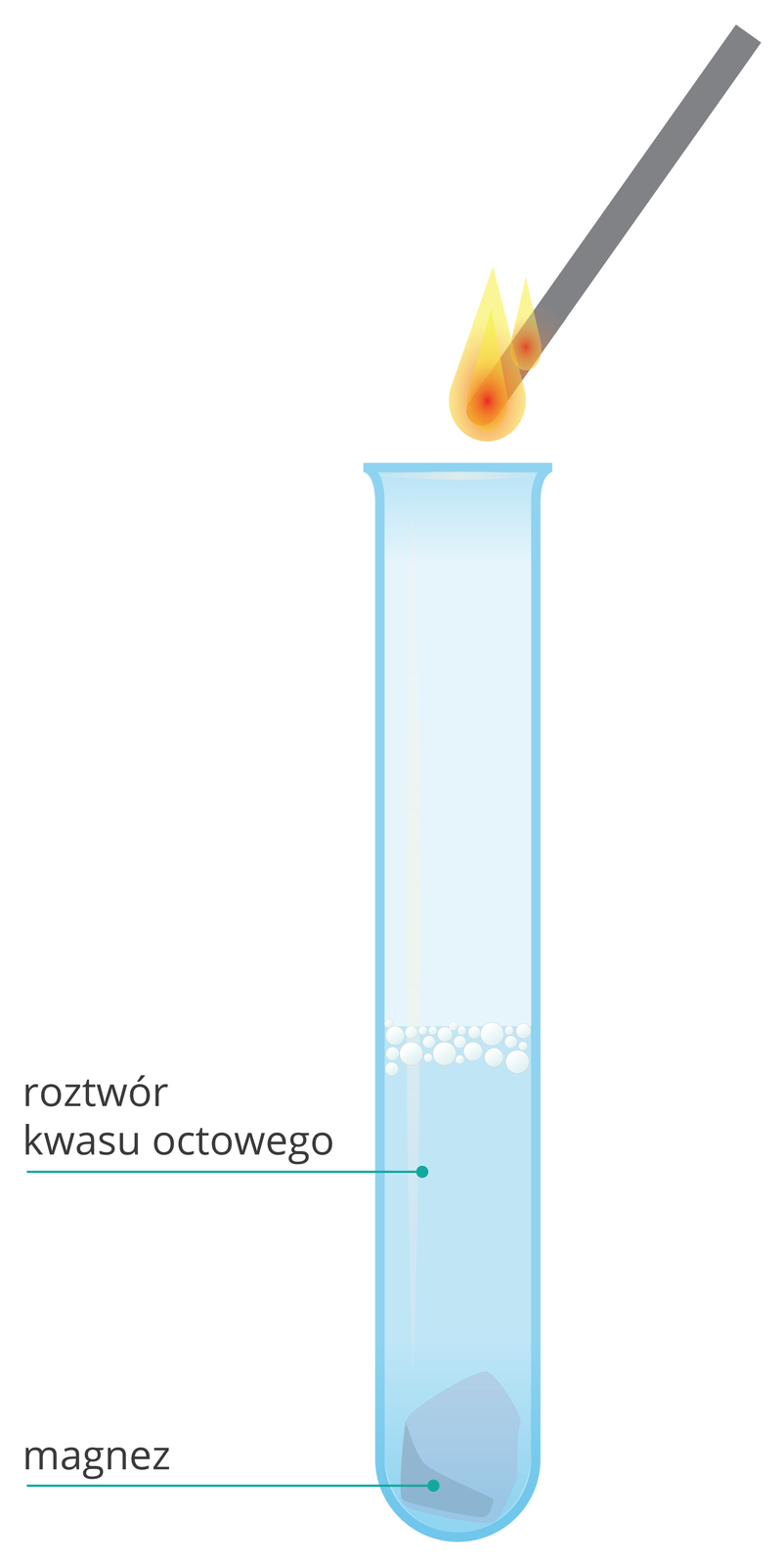 Działanie kwasu octowego na magnez
Działanie kwasu octowego na magnezRqrhBOG5hITrD1  Działanie kwasu octowego na magnez
Działanie kwasu octowego na magnez
Kwas octowy szybko reaguje z magnezem. Wydziela się bezbarwny, łatwopalny gaz. Zbliżenie palącego łuczywa do wylotu probówki powoduje efekt dźwiękowy – trzask charakterystyczny dla spalania wodoru.
Reakcja z tlenkami metalami
Czy kwas octowy reaguje z tlenkami metali?
Kwas octowy reaguje z tlenkiem miedzi(II) tak samo jak kwasy nieorganiczne.
wodny roztwór kwasu octowego,
tlenek miedzi(II),
probówka,
palnik.
Wlej do probówki ok. 3 cmIndeks górny 33 wodnego roztworu kwasu octowego.
Wrzuć do probówki trochę tlenku miedzi(II).
Lekko ogrzej probówkę.
Zwróć uwagę na zmiany barwy reagentów.
R13wpzcuyVAff1 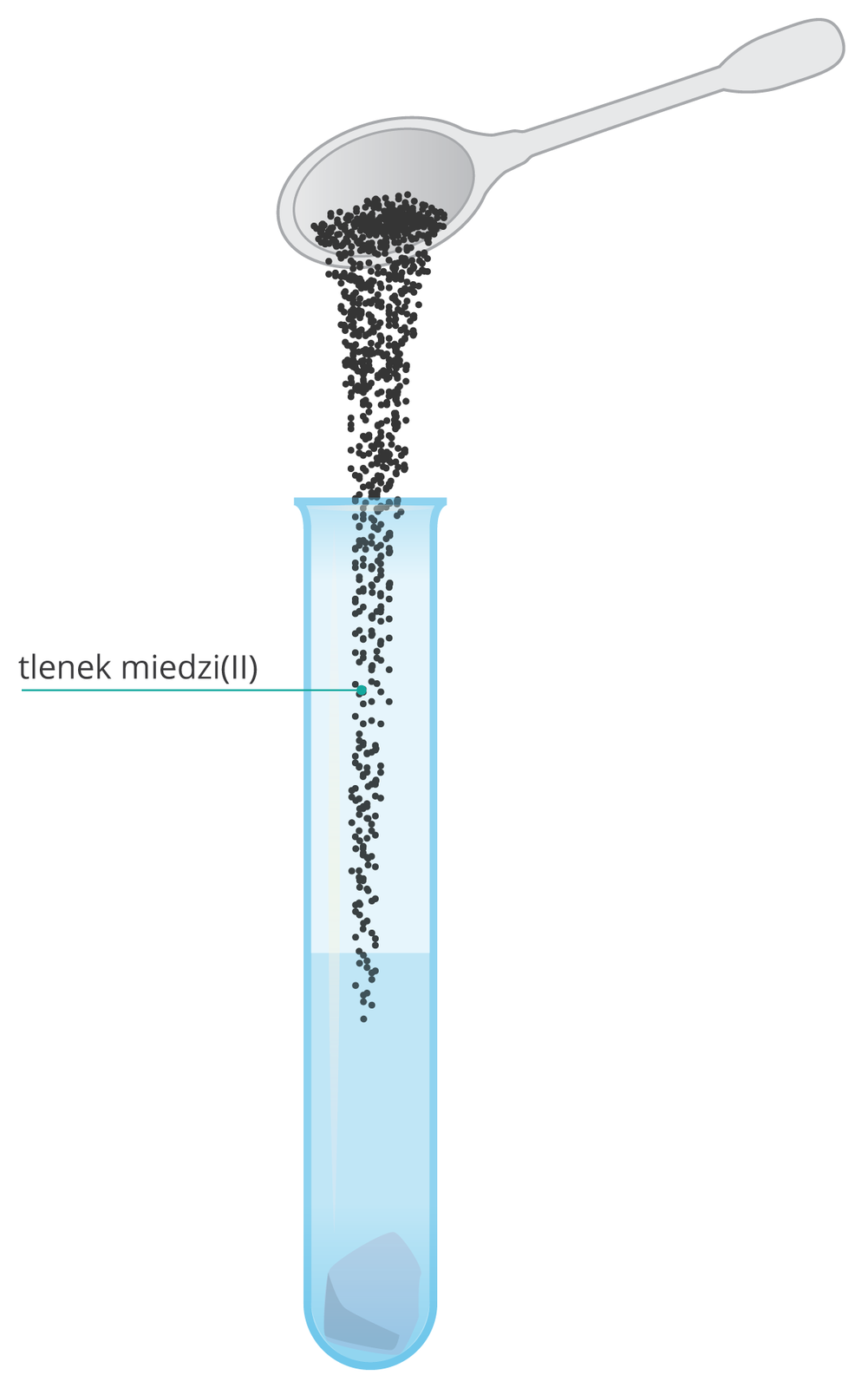 Działanie kwasu octowego na tlenek miedzi(II)
Działanie kwasu octowego na tlenek miedzi(II)ReVAmU0GsVTVA1  Działanie kwasu octowego na tlenek miedzi(II)
Działanie kwasu octowego na tlenek miedzi(II)
Tlenek miedzi(II) reaguje z kwasem octowym. Po lekkim ogrzaniu powstaje niebieski roztwór. Produktami reakcji są sól – octan miedzi(II) i woda.
3. Właściwości kwasu mrówkowego
Kwas metanowy , zwyczajowo zwany kwasem mrówkowym, jest przedstawicielem kwasów karboksylowych. Substancja ta jest ciekła, bezbarwna, o ostrym zapachu i dobrze rozpuszczalna w wodzie.
Jakie właściwości kwasu mrówkowego możemy odczytać z piktogramu?

Powoduje poważne oparzenia skóry i uszkodzenia oczu. Jest lotny, a jego pary drażnią błony śluzowe.
Roztwory wodne kwasu octowego i mrówkowego przewodzą prąd elektryczny oraz powodują czerwone zabarwienie soku z czerwonej kapusty. A zatem zachodzi reakcja dysocjacji elektrolitycznej:
Sole kwasu mrówkowego nazywamy mrówczanami. Powstają w wyniku reakcji kwasu mrówkowego z metalami, tlenkami metali i wodorotlenkami:
Podsumowanie
Czysty kwas octowy jest bezbarwną, żrącą cieczą. Jest higroskopijny (pochłania wilgoć z powietrza).
W temperaturze poniżej 16°C tworzy kryształy, które wyglądem przypominają lód. Nazywany jest również kwasem octowym lodowatym.
Kwasy octowy i mrówkowy dobrze rozpuszczają się w wodzie.
Odczyn wodnych roztworów kwasów karboksylowych o krótkich łańcuchach węglowych oraz przewodnictwo prądu elektrycznego świadczą o dysocjacji elektrolitycznej.
Kwasy karboksylowe reagują z wodorotlenkami, metalami i tlenkami metali, tworząc sole.
Wyjaśnij, czy kierując się wartością pH roztworów wodnych, można odróżnić kwas octowy od alkoholu etylowego?
Wyjaśnij, dlaczego miejsce po ukąszeniu komara jest zaczerwienione i bolesne? Jaki odczyn powinien mieć roztwór stosowany do przemywania zmiany skórnej?
Odpowiedz, z jakimi kwasami karboksylowymi kojarzą się następujące artykuły spożywcze: masło, jogurt, jabłko, cytryna czy szczaw.
Słowniczek
6‑procentowy lub 10‑procentowy wodny roztwór kwasu octowego; na półkach sklepowych możemy znaleźć kilka rodzajów octu (jabłkowy, winny, spirytusowy)
wodny roztwór kwasu octowego – produkt fermentacji spirytusu
Zadania
Ile wiązań chemicznych występuje w cząsteczce kwasu octowego?
- 8
- 7
- 5
- 4
- 3
Spośród podanych właściwości wskaż tę, która pozwoli odróżnić alkohol etylowy od kwasu octowego.
- smak kwaśny
- stan ciekły
- rozpuszczalność w wodzie
- bezbarwna ciecz
- tworzenie estrów
- reakcja z zasadami
Produktem reakcji spalania całkowitego kwasu octowego jest
- tlenek węgla(IV).
- tlenek węgla(II).
- węgiel.
- woda.
- tlen.
Połącz wzory kwasów i ich soli z nazwami zwyczajowymi tych związków.
<span aria-label="nawias CH indeks dolny, 3, COO zamknięcie nawiasu indeks dolny, 2, Cu" role="math"><math><mrow><msub><mrow><msub><mrow><mtext>(</mtext><mtext>CH</mtext></mrow><mtext>3</mtext></msub><mtext>COO</mtext><mtext>)</mtext></mrow><mtext>2</mtext></msub><mtext>Cu</mtext></mrow></math></span>, <span aria-label="CH indeks dolny, 3, COOH" role="math"><math><mrow><msub><mtext>CH</mtext><mtext>3</mtext></msub><mtext>COOH</mtext></mrow></math></span>, <span aria-label="CH indeks dolny, 3, COONa" role="math"><math><mrow><msub><mtext>CH</mtext><mtext>3</mtext></msub><mtext>COONa</mtext></mrow></math></span>, <span aria-label="HCOOH" role="math"><math><mrow><mtext>HCOOH</mtext></mrow></math></span>, <span aria-label="nawias CH indeks dolny, 3, COO zamknięcie nawiasu indeks dolny, 2, Mg" role="math"><math><mrow><msub><mrow><msub><mrow><mtext>(</mtext><mtext>CH</mtext></mrow><mtext>3</mtext></msub><mtext>COO</mtext><mtext>)</mtext></mrow><mtext>2</mtext></msub><mtext>Mg</mtext></mrow></math></span>
| kwas metanowy | |
| kwas etanowy | |
| octan sodu | |
| octan magnezu | |
| octan miedzi(II) |
Uzupełnij luki w tekście. Wybierz właściwe określenie spośród podanych.
jednokarboksylowych, jeden, kwasowy, wielokarboksylowych, dwa, obojętny, , zasadowy,
Kwas octowy jest pochodną węglowodoru nasyconego. Ma ...................................... atom(y) węgla w cząsteczce. Grupa funkcyjna charakterystyczna dla kwasów karboksylowych ma wzór ....................................... Kwas mrówkowy i octowy należą do kwasów ....................................... Niższe kwasy karboksylowe wykazują odczyn ...................................... . Dlatego fenoloftaleina nie zmienia swego zabarwienia w roztworze tego kwasu.